আপনি এখানে শিখবেন এই অধ্যায়ে এবং বিষয়ের ফাউন্ডেশন অংশটা, এই বিষয়টিকে সহজ-সরলভাবে পড়িয়েছেন বিশেষজ্ঞ শিক্ষক ভিডিও লেকচার এর মাধ্যমে এবং এই পুরো অধ্যায়কে চার ভাগে খন্ডিত করে আপনার জন্য তৈরি করা হয়েছে
প্রথম খন্ডে আপনি শিখবেন ফাউন্ডেশন অংশটা যেখানে অধ্যায়ের ব্যাপারে আপনাকে বোঝানো হয়েছে তার মানে definitions,basics গুলো সহজভাবে. এবং এটাকে আপনি বুঝতে পারবেন যেটা আপনাকে পরীক্ষার জন্য ক্রীপের করতে সাহায্য করবে
দ্বিতীয় মডিউলে আপনি শিখবেন MCQ মাল্টিপল চয়েস কোশ্চেন যেটা সাধারণত এক Marks’er আসে পরীক্ষায়
তৃতীয় মডিউলে আপনি শিখবেন শর্ট অ্যানসার এবং কোয়েশ্চেন, যেটা আপনার পরীক্ষার সাজেশন মধ্যে পড়ে এবং এটা 3-4 marks’er প্রশ্ন আসে আপনার পরীক্ষা
চতুর্থ মডিউল আপনি শিখবেন লং আনসার এবং questions যেটা সাধারণত 5-6 marks er হয়
আপনার যদি কোন প্রশ্ন থাকে তাহলে আমাদের সাথে যোগাযোগ করুন যাতে কি আপনাকে আমরা সাহায্য করতে পারি
Here you will learn the basics of CHAPTER 2 -Gaser Acharon – গ্যাসের in a simple language it is for Bengali medium students who are studying under West Bengal Board of Secondary Education and preparing for their exam (Class 10 WBBSE) Here you will find all necessary and important WBBSE Madhyamik Suggestions, notes, solved sample question paper in Bangla along with video lectures from expert teachers
সাধারণ পরিস্থিতিতে গ্যাসের আচরণ
গ্যাসের চাপ এবং আয়তন :
গ্যাসের আয়তন : গ্যাসীয় পদার্থের নিজস্ব কোনো আকার বা আয়তন নেই। কোনো পাত্রে গ্যাস রাখা হলে গ্যাসের অণুগুলো পাত্রের চারিদিকে ছড়িয়ে পরে এবং সেই পাত্রের আকার ও আয়তন ধারণ করে । সেক্ষেত্রে সেই পাত্রের আয়তনকেই গ্যাসের আয়তন বলা হয় । এজন্যই আয়তন উল্লেখ করার সময় চাপ ও উষ্ণতা উল্লেখ করতে হবে । ওই পদার্থের অণুগুলির মধ্যে গতিশক্তি খুব তীব্র হলেও, আকর্ষণ বল একদম নেই বললেই চলে ।
গ্যাসীয় পদার্থের আয়তনের এককসমূহ : গ্যাসীয় পদার্থের আয়তনের SI একক হল মিটার³ এবং CGS একক সেন্টিমিটার³ । এছাড়াও লিটার, মিলিলিটার ইত্যাদির এককের দ্বারাও গ্যাসীয় বস্তুর আয়তন প্রকাশ করা হয় ।
গ্যাসীয় পদার্থের চাপ : গ্যাসীয় পদার্থের অণুগুলো কখনোই স্থির অবস্থায় থাকে না; তারা সর্বদা গতিশীল। কোন প্রাত্রে কোন গ্যাসীয় পদার্থ রাখলে তার অণুগুলি পাত্রের সর্বত্র যেকোনো গতিবেগে ছড়িয়ে পড়ে। এর ফলস্বরূপ, অণুগুলি নিজেদের মধ্যে এবং পাত্রের সাথে ক্রমাগত সংঘর্ষে লিপ্ত হয়।
গ্যাসের অণুগুলি পাত্রের ভিতরের দেওয়ালে লম্বভাবে, প্রত্যেকটি বিন্দুতে বল প্রয়োগ করে। কোনো নির্দিষ্ট উষ্ণতায়, কোন আবদ্ধ পাত্রে অবস্থিত গ্যাসীয় পদার্থ ওই পাত্রের ভেতরের দেয়ালে একক ক্ষেত্রফলযুক্ত তলের ওপর লম্বভাবে যে বল প্রয়োগ করে থাকে গ্যাসের চাপ বলে ।
গ্যাসীয় পদার্থের চাপের বিভিন্ন একক সমূহ :
চিত্রে বর্ণিত এককটি ছাড়াও,গ্যাসের চাপকে আমরা বার, মিলিবার, অ্যাটমোসফিয়ার ইত্যাদি একক দ্বারাও পরিমাপ করে থাকি।
প্রমাণ উষ্ণতা এবং চাপ : 0°C বা 273 কেলভিন হলো প্রমাণ উষ্ণতা 0°C উষ্ণতায় 45° অক্ষাংশে সমুদ্রপৃষ্ঠে 76 সেন্টিমিটার দৈর্ঘ্য পারদ স্তম্ভ যে চাপ প্রয়োগ করে থাকে তাকেই প্রমাণ চাপ বা এক অ্যাটমসস্ফিয়ার (1 atm) বলে ।
প্যাস্কাল : 1 বর্গমিটার ক্ষেত্রের উপর এক নিউটন বল প্রযুক্ত করলে, যে পরিমাণ চাপের সঞ্চার হয় তাকেই এক প্যাস্কাল (Pa) বলা হয়। প্যাস্কাল হল চাপের SI একক ।
প্রমাণ চাপ এবং প্যাস্কালের মধ্যে সম্পর্ক :
প্রমাণ চাপ অথবা 1 atm = 0°c 76 সেন্টিমিটার পারদ স্তম্বের চাপ = পারদ স্তম্ভের উচ্চতা x 0°c পারদের ঘনত্ব x অভিকর্ষজ ত্বরণ = 76 x 13.5951 x 980.665 dyn cm⁻² = 1.01325 x 106 dyn cm⁻²।
1 Pascal = 1 Nm⁻²,
1 bar = 106 dyn cm⁻²
1 atm = 1.01325 x 10⁶ dyn cm⁻² = 101.325 kPa
গ্যাসের উষ্ণতা : কোন গ্যাসীয় পদার্থের উষ্ণতা সর্বদা ওই পদার্থের অণুগুলির গড় গতিশক্তির সমানুপাতিক। অর্থাৎ গ্যাসের অণুগুলির গতিশক্তি হ্রাস পেলে, গ্যাসের উষ্ণতা কমে যায় এবং গতিশক্তি বৃদ্ধি পেলে গ্যাসের উষ্ণতা বেড়ে যায় ।
গ্যাসীয় পদার্থের চাপের পরিমাপ : বিভিন্ন রাসায়নিক বিক্রিয়ায় গ্যাসকে আবদ্ধ পাত্রে রাখা হয় এবং ম্যানোমিটার যন্ত্রের মাধ্যমে গ্যাসের চাপ মাপা হয়।
- এই যন্ত্রটি আসলে একটি উভয় মুখ খোলা U আকৃতির কাচের নল, যার একটি বাহুর দৈর্ঘ্য অপর বাহু তুলনায় কম।
- এই নলটিকে পারদ দ্বারা আংশিক পরিপূর্ণ করার পর, এর ছোট বাহুটিকে গ্যাস দ্বারা পূর্ণ পাত্রের সাথে যুক্ত করা হয়।
- এরপর ওই নল দুটিতে অবস্থিত পারদের উচ্চতার পার্থক্য ও ব্যারোমিটারের দ্বারা বায়ুমণ্ডলীয় চাপের মান থেকে ওই আবদ্ধ গ্যাসের চাপ নির্ধারণ করা হয়ে থাকে।
বয়েলের সূত্র
বিজ্ঞানী রবার্ট বয়েল, 1662 খ্রিস্টাব্দে স্থির উষ্ণতায় নির্দিষ্ট ভরের গ্যাসের উপর চাপের প্রভাব সংক্রান্ত একটি সূত্র প্রবর্তন করেন যা বয়েলের সূত্র নামে পরিচিত।
বয়েলের সূত্রের সংজ্ঞা : স্থির উষ্ণতায় নির্দিষ্ট ভরের গ্যাসের আয়তন ওই গ্যাসের ওপর প্রযুক্ত চাপের সঙ্গে ব্যস্তানুপাতিক সম্পর্কে পরিবর্তিত হয়।
বয়েলের সূত্রের গাণিতিক রূপ : গাণিতিক ভাবে প্রকাশের জন্য ধরা যাক, আয়তন= V এবং চাপমাত্রা= P তাহলে গাণিতিকভাবে বয়েলের সূত্রানুসারে,
চাপ আয়তনের সাথে ব্যাস্তানুপাতিকভাবে সম্পর্কযুক্ত অর্থাৎ V ∝ 1/P
চাপ ও আয়তনের গুণফল যা একটি ধ্রুবকের সমান হয় অর্থাৎ PV = k
ধরে নেওয়া যাক, n মোল কোন গ্যাসীয় অণুর, উষ্ণতা T কেলভিন. চাপ P এবং আয়তন V ।
বয়েলের সূত্র থেকে আমরা বলতে পারি, V ∝ 1/P যখন n এবং T স্থির।
সুতরাং, V=K. 1/P
বা. PV = K
K হল একটি সমানুপাতিক ধ্রূবক এবং এর মান গ্যাসের পরিমাণের ওপর সর্বদা নির্ভরশীল।
ধরে নেওয়া যাক, কোন অপরিবর্তিত উষ্ণতায়, কোন নির্দিষ্ট পরিমাণ গ্যাসীয় পদার্থের চাপ P₁ এবং ওই গ্যাসীয় পদার্থের আয়তন V₁। ওই একই উষ্ণতায় চাপ P₂ হলে, ওই গ্যাসীয় পদার্থের আয়তন পরিবর্তিত হয়ে V₂ তে পরিণত হয়।
সুতরাং বয়েলের সূত্র অনুযায়ী আমরা বলতে পারি,
P₁V₁ = K এবং পরিবর্তিত অবস্থায় ইহা P2V₂=K
সুতরাং, P₁V₁ = P2V₂
বয়েলের সূত্রের ধ্রূবকসমূহ :
১) উষ্ণতা এবং ২) গ্যাসের ভর।
লেখচিত্রের দ্বারা বয়েলের সূত্রের উপস্থাপনা :
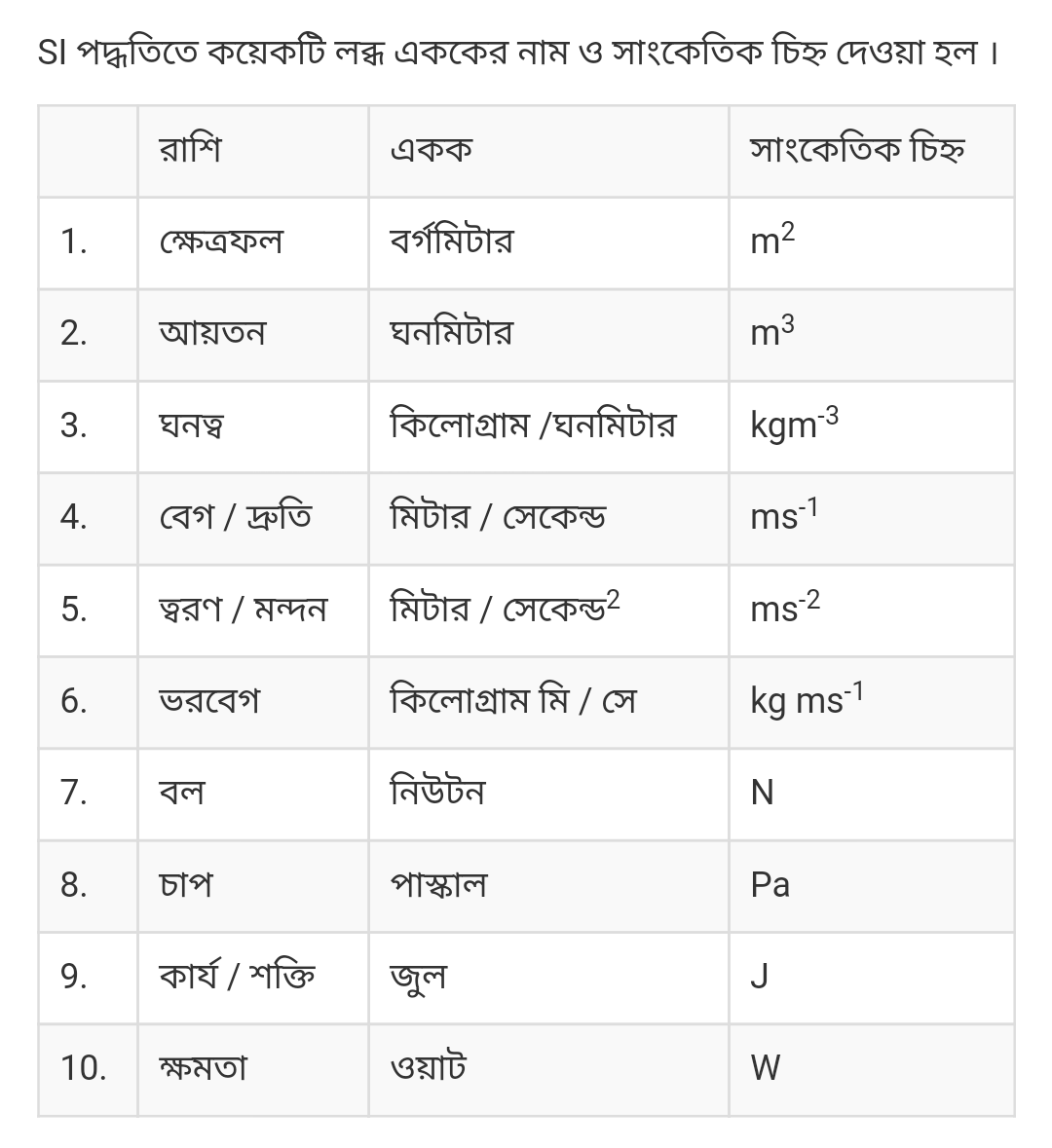
১) কোন স্থির উষ্ণতায় নির্দিষ্ট ভরের গ্যাসের P বনাম V- এর লেখচিত্র:
PV = K যেখানে K হলো একটি ধ্রূবক। লেখচিত্রটি একটি সমপরাবৃত্তাকার আকার নির্দেশ করে। তাপমাত্রা পরিবর্তনের সাথে সাথে এই লেখচিত্রেরও পরিবর্তন ঘটে।
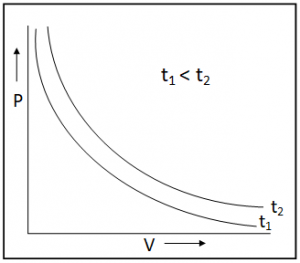
২) স্থির উষ্ণতায় নির্দিষ্ট ভরের কোন গ্যাসীয় উপাদান-এর PV বনাম P-এর লেখচিত্র :
বয়েলের সূত্র অনুযায়ী আমরা জানি, PV = K যেখানে K হলো একটি ধ্রূবক (যেখানে গ্যাসীয় উপাদানের উষ্ণতা এবং ভর অপরিবর্তনশীল) যেহেতু PV = k সেক্ষেত্রে PV-কে কোটি এবং P-কে ভুজ ধরে লেখচিত্র অঙ্কন করলে সর্বদা P অক্ষের সমান্তরাল সরলরেখা হবে।
বয়েলের সূত্র সংক্রান্ত গাণিতিক সমস্যার সমাধান –
স্থির উষ্ণতায় কোন নির্দিষ্ট ভরের গ্যাসের সংকোচন-প্রসারণে, গ্যাসের উপর সৃষ্ট চাপ বা আয়তন নির্ণয় করতে P₁V₁=P₂V₂ এই সমীকরণের যে কোন তিনটি রাশির মান জানা থাকলে, অপর রাশির মান খুব সহজেই আমরা গণনা করতে পারি।
১) একটি বেলুনে 95 সেন্টিমিটার Hg চাপে, 0.8 লিটার বায়ুর ভরা আছে। যদি উষ্ণতা স্থির রেখে, চাপ কমিয়ে 76 সেন্টিমিটার Hg-এ আনা হয় তবে ওই গ্যাসীয় পদার্থের আয়তন কত হবে?
প্রাথমিক অবস্থায় আমরা জানি,
চাপ (P₁) = 95 সেন্টিমিটার Hg
আয়তন (V₁) = 0.8 লিটার
পরিবর্তিত অবস্থায়,
চাপ (P₂) = 76 সেন্টিমিটার Hg
আয়তন (V₂)= ?
উষ্ণতা স্থির, সুতরাং বয়েলের সূত্র অনুযায়ী আমরা বলতে পারি,
P₁V₁ = P₂V₂
V₂=95 x 0.876 = 1
সুতরাং ওই গ্যাসীয় পদার্থের আয়তন হবে 1 লিটার।
চার্লসের সূত্র
1787 খ্রিস্টাব্দে বিজ্ঞানী চার্লস ও 1802 খ্রিস্টাব্দে গে-লুসাক তাদের গবেষণার দ্বারা অপরিবর্তিত চাপে স্থির ভরের গ্যাসের ক্ষেত্রে আয়তন এবং উষ্ণতার মধ্যে সম্পর্ক আবিষ্কার করেন যা চার্লসের সূত্র নামে পরিচিত।
চার্লসের সূত্রটি :
স্থির চাপে নির্দিষ্ট ভরের গ্যাসের আয়তন প্রতি 1°C উষ্ণতা বৃদ্ধি বা হ্রাসের ক্ষেত্রে, 0°C উষ্ণতায় ওই গ্যাসের আয়তনের 1/273 অংশ যথাক্রমে বৃদ্ধি বা হ্রাস পাবে ।
স্থির চাপে নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন গ্যাসটির পরম তাপমাত্রার সমানুপাতিক অর্থাৎ V ∝ T
সূত্রের ব্যাখ্যা :
ধরে নেওয়া যাক, n মোল কোন গ্যাসীয় অনুর, চাপ P স্থির। 0 ডিগ্রি সেলসিয়াস উষ্ণতায়, ওই গ্যাসের আয়তন V₀ এবং t ডিগ্রী সেলসিয়াস উষ্ণতায় ওই গ্যাসটির আয়তন Vᵗ। n,P এর মান স্থির থাকলে চার্লসের সূত্র অনুযায়ী, 0 ডিগ্রি সেলসিয়াস থেকে t ডিগ্রি সেলসিয়াস উষ্ণতা বৃদ্ধিতে ওই গ্যাসটির আয়তন বৃদ্ধি পাবে = t/273 V₀
সুতরাং আমরা বলতে পারি t ডিগ্রী সেলসিয়াস উষ্ণতায় গ্যাসটির আয়তন Vᵗ = V₀ + t/273 V₀ = (1+t/273) V₀
আবার, 0 ডিগ্রি সেলসিয়াস থেকে t ডিগ্রী সেলসিয়াস উষ্ণতা কমে গেলে গ্যাসের আয়তন কমবে= t/273 V₀
সুতরাং -t ডিগ্রী সেলসিয়াস উষ্ণতায় গ্যাসের আয়তন হবে= (1 – t/273)V₀
1/273 এই ভগ্নাংশটিকে আয়তন প্রসারণ গুণাঙ্ক ও আয়তন গুণাঙ্ক বলে।
চার্লসের সূত্রের ধ্রূবকসমুহ :
ক ) গ্যাসের চাপ এবং
খ) গ্যাসের ভর
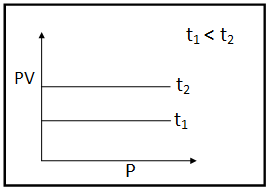
১) স্থির চাপে কোন নির্দিষ্ট ভরের গ্যাসের আয়তন বনাম সেলসিয়াস উষ্ণতার লেখচিত্র

স্থির চাপে নির্দিষ্ট ভরের কোন গ্যাসের বিভিন্ন উষ্ণতায় আয়তন নির্ণয় করে V-কে কোটি এবং t-কে ভুজ হিসেবে অঙ্কন করে যে লেখচিত্রটি পাওয়া যায় তা একটি সরলরেখা। এই সকল লেখাগুলিকে বর্ধিত করলে তা T অক্ষকে -273°C উষ্ণতায় ছেদ করে।
চার্লসের সূত্র সংক্রান্ত গাণিতিক সমস্যাগুলির সমাধান :
১) কোন নির্দিষ্ট ভরের গ্যাসের স্থির চাপে 0 ডিগ্রি সেলসিয়াস থেকে 273 ডিগ্রি সেলসিয়াস উষ্ণতায় উত্তপ্ত করা হলো। গ্যাসটির প্রাথমিক আয়তন এর সঙ্গে পরম আয়তনের সম্পর্ক নির্ধারণ করো।
সমাধান : ধরে নেওয়া যাক, 0 ডিগ্রি সেলসিয়াস উষ্ণতায় গ্যাসের আয়তন ছিল= V₀
273 ডিগ্রি সেলসিয়াস উষ্ণতায় ওই গ্যাস আয়তন হবে = V₂₇₃।
চাপ স্থির।
সুতরাং চার্লসের সূত্র অনুযায়ী আমরা বলতে পারি,
V₂₇₃ = (1 + 273/273) V₀ = (1+1) V₀ = 2V₀
সুতরাং গ্যাস্টিকের 0 ডিগ্রি সেলসিয়াস থেকে 273 ডিগ্রি সেলসিয়াস উষ্ণতায় উত্তপ্ত করার ফলে, গ্যাসটির পরম আয়তন , তার প্রাথমিক আয়তন-এর দ্বিগুণ হবে।
পরম উষ্ণতা স্কেল
চার্লসের সূত্র থেকে পরমশূন্যের ধারণা :
চার্লসের সূত্রানুযায়ী Vᵗ= (1+273/273)V₀
সুতরাং, -273°C উষ্ণতায় ওই গ্যাসের আয়তন হবে
V₋₂₇₃°C = (1+-273/273) V₀
or, V-273°C=(1-273273)V0
= 0
সুতরাং, -273°C তাপমাত্রায় কোনো গ্যাসীয় পদার্থের আয়তন স্থির চাপে সর্বদা শুন্য হয় । অন্যদিকে কঠিন বা তরল কোনো ক্ষেত্রে চার্লসের সূত্র প্রযোজ্য হয় না। কাজেই কোনো গ্যাসের আয়তন বাস্তবে শূন্যে আনা সম্ভব নয়। তাই বিজ্ঞানীরা -273°C তাপমাত্রাকে পরম শূন্য তাপমাত্রা বলেছেন।
পরম শূন্য :
চার্লসের সূত্র অনুযায়ী, অপরিবর্তিত চাপে যে উষ্ণতায় সকল গ্যাসীয় পদার্থের আয়তন শূন্যে রূপান্তরিত হয় তাকেই পরমশূন্য বলা হয়। সেলসিয়াস স্কেলে পরমশুন্যের মান -273°C ।
পরমশূন্যকে ‘পরম’ বলার কারণ :
গ্যাসের প্রকৃতি, চাপ, পরিমাণ বা আয়তন কোন কিছুর ওপরেই পরমশূন্য উষ্ণতার মান নির্ভর করে না; আবার এর থেকে কম উষ্ণতা পাওয়া সম্ভব নয়। মূলত এই কারণেই পরমশূন্যকে পরম বলে অভিহিত করা হয়।
উষ্ণতার পরম স্কেল বা কেলভিন স্কেল এবং কেলভিন উষ্ণতা :
কেলভিন স্কেল 1848 খ্রিস্টাব্দে, ব্রিটিশ বিজ্ঞানী লর্ড কেলভিন প্রবর্তন করেন, যিনি উইলিয়াম থমসন নামেও পরিচিত। এই স্কেলে -273°C-কে শূন্য বিন্দু এবং উষ্ণতার প্রতি ডিগ্রিকে সেলসিয়াস স্কেলের 1°-এর সমান ধরা হয়, তাকে পরম বা কেলভিন স্কেল বলে। এই স্কেল অনুযায়ী কোনো উষ্ণতার মানকে কেলভিন উষ্ণতা বা পরম উষ্ণতা বলা হয়।
সেলসিয়াস স্কেল এবং কেলভিন স্কেলের সম্পর্কে :
সেলসিয়াস স্কেল এবং কেলভিন স্কেলের মধ্যে সম্পর্ক হল : T= 273+t । যেখানে T, হল কেলভিন স্কেলে উষ্ণতার মান এবং t হল সেলসিয়াস স্কেলে উষ্ণতার মান। সেলসিয়াস স্কেলে উষ্ণতা 273°C বাড়লে কেলভিন স্কেলের উষ্ণতা 273 k বাড়ে কারণ -273°C-কে 0 K ধরা হয়।
কেলভিন স্কেল এর নিরিখে চার্লসের সূত্রের ব্যাখ্যা : ধরে নেওয়া যাক 0 ডিগ্রি সেলসিয়াস উষ্ণতায় কোন নির্দিষ্ট ভরের গ্যাসের আয়তন V₀, t₁ ডিগ্রী সেলসিয়াস উষ্ণতায় কোন গ্যাসের আয়তন V₁, এবং t₂ ডিগ্রী সেলসিয়াস উষ্ণতায় কোন গ্যাসের আয়তন V₂। t₁, t₂ডিগ্রী সেলসিয়াসের কেলভিন স্কেলের মান যথাক্রমে T₁K, T₂K।
চার্লসের সূত্র অনুযায়ী আমরা বলতে পারি, V₁= (273 +t₁ / 273)V₀ এবং V2= (273 + t₂ / 273)V₀
সুতরাং V₁/V₂=T₁/T₂, V∝ T
কেলভিন স্কেল অনুযায়ী চার্লসের সূত্রের বিকল্প রূপ:
অপরিবর্তিত চাপে, কোনো নির্দিষ্ট ভরের গ্যাসের পদার্থের আয়তন ওই গ্যাসীয় পদার্থের পরম উষ্ণতার সঙ্গে সমানুপাতিক, V∝ T
স্থির চাপে পরম উষ্ণতা এবং নির্দিষ্ট ভরের গ্যাসের আয়তনের মধ্যে সম্পর্ক :

স্থির চাপে নির্দিষ্ট ভরের গ্যাসের পদার্থের বিভিন্ন পরম উষ্ণতা আয়তন নির্ধারণ করে V বনাম T লেখচিত্র অঙ্কন করলে, তা একটি মূলবিন্দুগামী সরলরেখা হয়। এই লেখচিত্র অনুযায়ী স্থির চাপে পরমশূন্য উষ্ণতায় গ্যাসের আয়তন 0 এবং নির্দিষ্ট ভরের গ্যাসের আয়তন স্থির চাপে ওই গ্যাসটির পরম উষ্ণতার সঙ্গে সমানুপাতিক ।
স্থির আয়তনে নির্দিষ্ট ভরের গ্যাসের চাপ এবং পরম উষ্ণতা মধ্যে সম্পর্ক :

স্থির আয়তনে, সুনির্দিষ্ট ভরের কোনো গ্যাসের উপাদানের বিভিন্ন উষ্ণতায় চাপ নির্ধারণ করে, P বনাম T লেখচিত্র অঙ্কন করলে তা আলাদা আলাদা মূলবিন্দুগামী সরলরেখার নির্দেশ করে। এই লেখচিত্র অনুযায়ী স্থির আয়তনে পরমশূন্য উষ্ণতায় সকল গ্যাসীয় পদার্থের চাপ 0 হয় এবং স্থির আয়তনে নির্দিষ্ট ভরের গ্যাসের চাপ ওই গ্যাসটির পরম উষ্ণতার সঙ্গে সমানুপাতিক ।
পরম শূন্য এবং চার্লসের সূত্র সম্পর্কিত সরল গাণিতিক সমস্যা সমাধান :
স্থির চাপে সুনির্দিষ্ট ভরের গ্যাসের আয়তন অথবা উষ্ণতা পরিবর্তনে, গ্যাসের উষ্ণতা বা আয়তন নির্ণয় করতে চার্লসের সূত্র অনুযায়ী V₁V₂=T₁T₂ কে কাজে লাগিয়ে গ্যাসীয় পদার্থের চাপ বা আয়তন গননা করতে হবে । এক্ষেত্রে আমাদের মনে রাখতে হবে উষ্ণতাকে অবশ্যই কেলভিন স্কেলে পরিবর্তন করতে হবে।
- স্থির চাপে 15 ডিগ্রি সেলসিয়াস উষ্ণতায় নির্দিষ্ট পরিমাণ কোন গ্যাসীয় পদার্থের আয়তন 360 মিলিলিটার। উষ্ণতা কত হলে ওই গ্যাসীয় পদার্থের আয়তন 480 মিলিলিটার হবে?
এক্ষেত্রে : V₁ = 360 mL, T₁= (273+15) = 288 K,
V₂ = 480 mL, T₂=?
চার্লসের সূত্র অনুযায়ী আমরা বলতে পারি,
V₁/V₂ =T₁/T₂, T₂ = (480 X 288)/360= 384 K.
সুতরাং, T₂ = 384 K= (384-273) = 111 ডিগ্রী সেলসিয়াস।
চার্লসের সূত্র ও বয়েলের সূত্রের মধ্যে সমন্বয় :
ধরা যাক গ্যাসের পরিমাণ= n মোল এবং আয়তন= V, চাপ= P,
পরম স্কেলে তাপমাত্রা = T
বয়েলের সূত্রানুযায়ী V ∝ (1/P) —– (1) [যখন T এবং n স্থির]
চার্লসের সূত্রানুযায়ী V∝ T —– (2) [যখন P এবং n স্থির]
(1) ও (2) নং সমীকরণকে সমন্বয় করে আমরা পাই,
V ∝ (1/P) [যখন T ও P পরিবর্তনশীল এবং n স্থির]
সুতরাং, V = KT/P [যেখানে k হল একটি সমানুপাতিক ধ্রুবক]
PV = KT
‘n’ মোল কোন গ্যাসীয় অনুর P₁ চাপে T₁ উষ্ণতায়, আয়তন V₁ এবং P₂
চাপে T₂ উষ্ণতায়, আয়তন V₂ হলে
P₁V₁/T₁ = P₂V₂/T₂
বয়েলের সূত্র ও চার্লসের সূত্রের সমন্বয় সংক্রান্ত গাণিতিক সমস্যার সমাধান :
পূর্বনির্ধারিত সমীকরণে যেকোনো পাঁচটি মান প্রদত্ত থাকলে, ষষ্ঠ মানকে খুব সহজেই নির্ণয় করা যায়। এক্ষেত্রে মনে রাখতে হবে মুসলমান কাকে সবসময়ের সেলসিয়াস থেকে কেলভিনে পরিবর্তন করতে হবে।
- 0 ডিগ্রি সেন্টিগ্রেড উষ্ণতায় কোন গ্যাসীয় পদার্থ কে উত্তপ্ত করলে তার আয়তন এবং চাপ উভয়েই দ্বিগুণহারে বৃদ্ধি পায়। ওই গ্যাসের চূড়ান্ত উষ্ণতা কত হবে?
এক্ষেত্রে : P₁= 0 ডিগ্রি সেলসিয়াস, V₁=0, T₁= 273 K
P₂ = 2P₁, V₂=2V₁, T₂ = (273+t) K
P₁V₁/T₁ = P₂V₂/T₂
P₁V₁/273 = 2P₁.2V₁/(273+t)
t = 819 ডিগ্রী সেলসিয়াস।
অ্যাভোগাড্রো প্রকল্প :
ইতালির বিজ্ঞানী অ্যাভোগাড্রো, 1817 খ্রিস্টাব্দে, তাঁর বিভিন্ন গবেষণার ফলাফল নিয়ে বিখ্যাত প্রকল্প উপস্থাপনা করেন যা অ্যাভোগাড্রো সূত্র নামে পরিচিত।
অ্যাভোগাড্রো সূত্রের সংজ্ঞা : একই চাপ এবং উষ্ণতায় সম আয়তনের সকল গ্যাসে সমসংখ্যক অণু অবস্থান করে অর্থাৎ V ∝ n
অ্যাভোগাড্রো সূত্রের ব্যাখ্যা :
ধরে নেওয়া যাক, P mm Hg চাপে এবং T K উষ্ণতায়, V mL হাইড্রোজেন গ্যাসের অণুর সংখ্যা = n,
সুতরাং, P mm Hg চাপে T K উষ্ণতায়, V mL হাইড্রোজেন, নাইট্রোজেন, মিথেন, ইথেন ইত্যাদি সকল প্রকার গ্যাসে অণুর সংখ্যা n হবে।
অ্যাভোগাড্রো সূত্রের গাণিতিক রূপ :
সুনির্দিষ্ট চাপে এবং উষ্ণতায় নির্দিষ্ট ভরের আদর্শ গ্যাসের আয়তন এবং পরিমাণ পরস্পরের সমানুপাতিক।
অ্যাভোগাড্রো সূত্র অনুসারে,
কোন গ্যাসের আয়তন V হলে এবং স্থির চাপে এবং উষ্ণতায় তার পরিমাণ n হলে,
V ∝ n বা, V = Kn ( K হলো একটি সমানুপাতিক ধ্রুবক) অপরিবর্তনশীল চাপ ও উষ্ণতায়, n₁ এবং n₂ মোল অণু পরিমাণ কোন গ্যাসের আয়তন যথাক্রমে, V₁ এবং V₂ হলেই
V₁/n₁ = V₂/n₂
আমাদের মনে রাখতে হবে, অ্যাভোগাড্রো যখন তাঁর সূত্র বা প্রকল্পটি প্রকাশ করেন, তখন অণু-পরমাণু সম্পর্কে কোনরূপ স্পষ্ট ধারণা উপলব্ধ ছিল না। কাজেই সূত্রটিতে উল্লেখিত গ্যাসের আয়তন গ্যাসটি দ্বারা অধিকৃত অঞ্চলকে নির্দেশ করে। এই আয়তনের সঙ্গে অণুর আয়তনের কোনরূপ সম্পর্ক নেই।
গে-লুসাকের সূত্র :
1808 খ্রিস্টাব্দে, গে-লুসাক নামক এক ফরাসি বিজ্ঞানী গ্যাসের আয়তন সংক্রান্ত একটি সূত্র আবিষ্কার করেন যা গে-লুসাকের গ্যাস আয়তনিক সূত্র নামে পরিচিত ।
গে-লুসাকের সূত্রের সংজ্ঞা : একই চাপ এবং উষ্ণতায় গ্যাসীয় বিক্রিয়ায় অংশগ্রহণকারী বিকারক গ্যাসসমূহ, তাদের আয়তনের সরল অনুপাতের বিক্রিয়া করে এবং তা থেকে উৎপন্ন গ্যাসীয় পদার্থ ওই একই চাপ ও উষ্ণতায় উৎপন্ন গ্যাসের আয়তনও বিকারক গ্যাসসমূহের আয়তনের সাথে সরল অনুপাতে থাকে।
উদাহরণ : বিভিন্ন পরীক্ষার মাধ্যমে দেখা যায়, স্থির চাপ ও উষ্ণতায় একক আয়তন হাইড্রোজেন এবং একক আয়তনে ক্লোরিনের বিক্রিয়ায় সর্বদা 2 আয়তন হাইড্রোজেন ক্লোরাইড উৎপন্ন হয়। এই বিক্রিয়ায় হাইড্রোজেন, ক্লোরিন এবং হাইড্রোজেন ক্লোরাইডের আয়তনিক অনুপাত সর্বদা 1 : 1 : 2 সরল অনুপাতে থাকবে।
অ্যাভোগাড্রো সূত্র অনুযায়ী গে-লুসাকের গ্যাস আয়তনিক সূত্রের পর্যাপ্ত ব্যাখ্যা :
ধরে নেওয়া যাক, একটি নির্দিষ্ট উষ্ণতায় এবং চাপে, A গ্যাসের a সংখ্যক অণু + B গ্যাসের b সংখ্যক অণু = C গ্যাসের c সংখ্যক অণু । যদি পরীক্ষা চলাকালীন চাপ ও উষ্ণতায় A গ্যাসের V আয়তনে n সংখ্যক অণু থাকে তবে সূত্র অনুযায়ী ওই একই চাপ ও উষ্ণতায় B ও C গ্যাসের প্রত্যেকটির V আয়তনে n সংখ্যক অণু থাকবে।
সুতরাং একই চাপ ও উষ্ণতায় A, B ও C গ্যাসের আয়তনের অনুপাত হবে Va/n :Vb/n :Vc/n = a :b :c
অনুপাতটি সর্বদা সরল অনুপাতে থাকে।
শুস্ক বায়ুর থেকে আর্দ্র বায়ু হাল্কা হওয়ার কারণ :
স্থির উষ্ণতায় বাতাসে জলীয়বাষ্পের পরিমাণ বৃদ্ধি পেলে বাতাসের ঘনত্ব হ্রাস পায়। জলীয়বাষ্প অক্সিজেন ও নাইট্রোজেনের থেকে হালকা। ফলে একক আয়তনের বাতাসে জলীয়বাষ্প অন্যান্য গ্যাসগুলিকে প্রতিস্থাপন করতে থাকে, বাতাসের ঘনত্ব তত কমতে থাকে। তাই বলা যায়, একই উষ্ণতায় শুষ্ক বায়ুর চেয়ে আর্দ্র বায়ু হালকা হয়ে থাকে।
আদর্শ গ্যাস সমীকরণ :
ধরে নেওয়া যাক,
P = গ্যাসের চাপ, V = গ্যাসীয় পদার্থের আয়তন, n = গ্যাসীয় পদার্থের পরিমাণ( অনুর সংখ্যা) T= কেলভিন উষ্ণতা এই চারটি রাশি দ্বারা আমরা গ্যাসীয় অবস্থার সমীকরণ নির্ধারণ করতে পারি।
চার্লসের সূত্র, বয়েলের সূত্র এবং অ্যাভোগাড্রো সূত্রের সমন্বয়ে একটি সাধারণ সমীকরণ আমরা ব্যবহার করি তাকেই আদর্শ গ্যাসের অবস্থান সমীকরণ বলা হয়ে থাকে।
বয়েলের সূত্র থেকে আমরা পাই, V ∝ 1/P
চার্লসের সূত্র থেকে আমরা পাই, V ∝ T
অ্যাভোগাড্রো সূত্র অনুযায়ী, V ∝ n
এইটি ওষুধ জকের সমন্বয় করে আমরা পাই V ∝ nT/P
V= K(nT/P), K হলো একটি সমানুপাতিক ধ্রুবক।।……(1)
পরীক্ষালব্ধ ফলাফল থেকে আমরা জানতে পারি, 1 মোল পরিমাণ অনু যে কোন গ্যাসের ক্ষেত্রে K এর মানের সমান হয়ে থাকে।
1 মোল অনু পরিমাণ যে কোন গ্যাসের ক্ষেত্রে K কে R দ্বারা প্রতিস্থাপন করা হয়। সুতরাং PV=nRT……..(2)
এই দুই নম্বর সমীকরণ থেকে আমরা n মোল অণু আদর্শ গ্যাসের অবস্থার সমীকরণ বলে থাকি।
আদর্শ গ্যাস :
যেসকল গ্যাসসমূহ যেকোনো পরিস্থিতিতে চার্লস ও বয়েলের সূত্র মেনে চলে তাদের আদর্শ গ্যাস বলা হয় এবং যে সকল গ্যাস এই দুই সূত্র মেনে চলে না তাদের বাস্তব বা প্রকৃত গ্যাস বলে। প্রকৃতপক্ষে আদর্শ গ্যাসের কোনো অস্তিত্বই নেই কারণ এমন কোনো গ্যাস নেই যা এই দুই সূত্রকে সঠিকভাবে মেনে চলে । কাজেই আদর্শ গ্যাস একটি নিছক কল্পনা।
হাইড্রোজেন, অক্সিজেন, কার্বন-ডাই-অক্সাইড, নাইট্রোজেন, হিলিয়াম ইত্যাদি সকল প্রকার গ্যাসই বাস্তব গ্যাস। আদর্শ গ্যাসের কোনরূপ অস্তিত্ব না থাকলেও সাধারণ অবস্থায় প্রমাণ উষ্ণতা এবং চাপে বেশিরভাগ বাস্তব গ্যাসই আদর্শ গ্যাসের মত আচরণ করে।
আণবিক স্তরে গ্যাসের আচরণ :
Clausius, Boltzman, Maxwell ও অন্যান্য বিজ্ঞানীদের প্রচেষ্টায় অষ্টাদশ শতাব্দীতে গ্যাসীয় পদার্থের আচরণ এবং গঠন সম্পর্কিত সৃষ্ট তত্ত্বকে গ্যাসীয় গতীয় তত্ত্ব বলা হয়। এই তত্ত্বের দ্বারা আণবিক স্তরে একটি আদর্শ গ্যাসের আচরণকে সহজেই ব্যাখ্যা করা যায়।
- প্রত্যেকটি গ্যাস স্থির ভর এবং আকারযুক্ত গোলাকার, ক্ষুদ্র, এবং পূর্ণ স্থিতিস্থাপক কণা দ্বারা গঠিত এই কণাগুলোই হলো অণু।
- এই গ্যাসের অণুগুলি বিন্দু ভরের ন্যায়। অণুগুলোর নিজস্ব আয়তন পাত্রের আয়তনের তুলনায় খুবই নগণ্য।
- গ্যাসীয় পদার্থের অণুগুলির গড় গতিশক্তি, গ্যাসের পরম উষ্ণতার সঙ্গে সমানুপাতিক সম্পর্কে থাকে।
- গ্যাসের অণুগুলির মধ্যে কোনরূপ আকর্ষণ বিকর্ষণ বল থাকে না।
- গ্যাসীয় অণুগুলি পরস্পরের সঙ্গে সংঘর্ষের সময়, তাদের গতির দিক পরিবর্তন হয় ঠিকই কিন্তু তাদের মোট গতিশক্তির পরিমাণে কোন রূপ পরিবর্তন আসে না।
গ্যাসের অণুর গতিবেগ :
সকল গ্যাসের অনু, বিশৃঙ্খল এবং অবিরাম গতিতে সর্বদা সঞ্চালনশীল। কিন্তু, গ্যাসের অনুগুলির গতিবেগ কখনও সমান হয় না। কোন একটি বিশেষ গ্যাসীয় অনুর গতিবেেগের দিক এবং মান সর্বদা পরিবর্তিত হতে থাকে।
যদি কোনো বিশেষ মুহূর্তে n সংখ্যক গ্যাসীয় অণুর বেগ, CC1,C2,C3,……Cn হয়ে থাকে তাহলে অনুগুলির গড় বেগ C = C1+C2+C3+…..+Cn/n
ব্যাপন প্রক্রিয়া : কোনো হল ঘরের এক প্রান্তে কোনো সুগন্ধির বোতল রাখলে, খুব অল্প সময়ের মধ্যে তার সুগন্ধ ঘরের সর্বত্র ছড়িয়ে পড়ে। এই ঘটনাটিকে গ্যাসের ব্যাপন বলে । গ্যাসীয় পদার্থের অণুগুলো অবিরাম দ্রুত এবং বিশৃঙ্খলা গতিতে ছুটে বেড়ায়; অণুগুলির নিজস্ব কোনো অভ্যন্তরীণ বল না থাকায় এরা নিজেদের মধ্যে বিক্রিয়া ঘটাতে পারে না। এইভাবে গ্যাসের ব্যাপন ঘটে থাকে।
গ্যাসীয় ব্যাপন প্রক্রিয়া : যে ধর্মের জন্য পরস্পর বিক্রিয়া করে না এমন দুই বা ততোধিক গ্যাসীয় পদার্থের ঘনত্ব, আণবিক গুরুত্ব নির্বিশেষে বাহ্যিক কোনো সাহায্য ছাড়াই স্বতঃস্ফূর্তভাবে মিশ্রিত হতে পারে তাকে গ্যাসীয় ব্যাপন বলা হয়।
গ্যাসীয় পদার্থের আয়তনের উপর চাপের প্রভাব : অপরিবর্তনশীল উষ্ণতায়, নির্দিষ্ট ভরের কোন গ্যাসের চাপ P এবং তার আয়তন V হলে PV = চাপ X আয়তন = ( বল/ ক্ষেত্রফল) X আয়তন = (বল X দৈর্ঘ্য³) x দৈর্ঘ্য³ = বল x দৈর্ঘ্য = কার্য বা শক্তি অর্থাৎ PV = শক্তি।
গ্যাসীয় পদার্থের অণুর বেগ এবং চাপের উপর উষ্ণতার প্রভাব : নির্দিষ্ট ভরের গ্যাসকে উত্তপ্ত করলে গ্যাসের অণুগুলির গতিশক্তি বৃদ্ধি পায়, সুতরাং উষ্ণতা বৃদ্ধি করলে গ্যাসের অনুগুলির বেগ বাড়ে। ফলে তাদের মধ্যে পারস্পরিক এবং পাত্রের দেওয়ালে সংঘর্ষের মাত্রা বৃদ্ধি পায়। ফলে গ্যাসের চাপেরও বৃদ্ধি ঘটে । অপরদিকে, গ্যাসের উষ্ণতা হ্রাস পেলে, গ্যাসের চাপ এবং গতিবেগ উভয়ই হ্রাস পায়।
বাস্তব গ্যাসের আচরণ এবং আদর্শ গ্যাসের আচরণ :
বাস্তব গ্যাসগুলি কখনোই আদর্শ গ্যাসের মত PV = nRT সূত্রকে মেনে চলতে পারে না। সকল বাস্তব গ্যাসই আদর্শ গ্যাসের থেকে বহু অংশে আলাদা। এই বিচ্যুতির মূল দুটো কারণ উল্লেখ করা হয় :
- গ্যাসীয় গতিতত্ত্বে, গ্যাসের অণুগুলিকে বিন্দুভর বিশিষ্ট কণা হিসেবে মান্য করা হয় এবং গ্যাসীয় অণুগুলির মোট আয়তন গ্যাস যে পাত্রে রাখা হয় তার তুলনায় খুব ক্ষুদ্র হিসাবে গণ্য করা হয়। কিন্তু প্রকৃতপক্ষে বাস্তব গ্যাসের অণুগুলি খুব ছোট হলেও তাদের সুনির্দিষ্ট আয়তন আছে। তাই উপযুক্ত কল্পনা পুরোপুরি নির্ভুল নয়।
- গ্যাসীয় গতিতত্ত্ব অনুযায়ী গ্যাসের অণুগুলির মধ্যে আকর্ষণ বল থাকে না। কিন্তু চাপ বৃদ্ধি পেলে গ্যাসের আয়তন কমে আসে এবং অণুগুলির পরস্পরের কাছাকাছি অবস্থান করে। এমত অবস্থায় অণুগুলির মধ্যে পারস্পরিক আকর্ষণ বল কাজ করে।
SOLVED QUESTIONS & ANSWERS of Gaser Acharon – গ্যাসের আচরণ
1 MARKS QUESTIONS of Gaser Acharon – গ্যাসের আচরণ
সিজিএস পদ্ধতিতে সর্বজনীন গ্যাস ধ্রুবক R-এর একক কী?
ANS- সর্বজনীন গ্যাস ধ্রুবক R-এর একক হলাে 8.314 x 10⁷erg mol⁻¹k⁻¹
চার্লসের সূত্রের লেখচিত্রটির প্রকৃতি কীরূপ?
ANS- যে চার্লসের সুত্রের লেখচিত্রটি মূল বিন্দুগামী সরলরেখা।
আদর্শ গ্যাসের অণুগুলির স্থির চাপে গ্যাসের আয়তন প্রসারণ গুণাঙ্কের মান ক্ষত? |
ANS- 1/273 প্রতি °C.
বাস্তব গ্যাসগুলি কোন ক্ষেত্রে আদর্শ গ্যাসের মতাে আচরণ করে ?
ANS- বাস্তব গ্যাসগুলি উচ্চতাপমাত্রা ও নিম্নচাপে আদর্শ গ্যাসের মতাে আচরণ করে।
চার্লসের সূত্র অনুযায়ী আদর্শ গ্যাসের ক্ষেত্রে V – t লেখচিত্রটির প্রকৃতি কীরূপ?
ANS- সরলরেখা।
উষ্ণতার সাপেক্ষে চার্লসের সূত্রের গাণিতিক রূপ লেখাে।
ANS- VT = ধ্রুবক ।
30 ডিগ্রি সেন্টিগ্রেড ও 300 K-এর মধ্যে কোনটি বেশি উষ্ণতা প্রকাশ করে ?
ANS- 30° সেন্টিগ্রেড।
অ্যাভােগাড্রো প্রকল্পটি লেখাে।
ANS- সমচাপে ও সম তাপমাত্রায় সম আয়তন সকল গ্যাসীয় পদার্থের মধ্যে অণুর সংখ্যা সর্বদাই সমান ।
কেলভিন স্কেলে উৰ্দ্ধ ও নিম্ন স্থিরাঙ্ক কত?
ANS- কেলভিন স্কেলে উৰ্ব্ব ও নিম্ন থিরাঙ্ক যথাক্রমে 373 K ও 273 K.
অপরিবর্তিত চাপে নির্দিষ্ট ভরের কোনাে গ্যাসের পরম স্কেলে প্রকাশিত ‘তাপমাত্রা ও আয়তন-এর মধ্যে সম্পর্ক কী?
ANS- চরম স্কেলে গ্যাসের তাপমাত্রা ও আয়তন-এর মধ্যে সমানুপাতিক সম্পর্ক।
Multiple Choice Questions – of Gaser Acharon – গ্যাসের আচরণ 1 marks
এদের মধ্যে কোনটি বয়েল সূত্রের গাণিতিক রূপ? (T = স্থির)
- V ∝ 1/P
- V ∝ P
- V ∝ T
- V ∝ 1/T
Ans. V ∝ 1/P
কোন নির্দিষ্ট তাপমাত্রায়, গ্যাসের চাপ কমিয়ে 1/3 অংশ করা হলে , আয়তন কত হবে ?
A.আয়তন 9 গুণ বাড়বে
B.আয়তন 3 গুণ বৃদ্ধি পাবে
C.কোনাে পরিবর্তন হবে না
D.আয়তন 1/3অংশ কমে যাবে
Ans- আয়তন 3 গুণ বৃদ্ধি পাবে
এদের মধ্যে কোনটি চালর্স সূত্রের গাণিতিক রূপ ? (P = স্থির)
- V ∝ T
- V ∝ P
- V ∝ 1/P
- V ∝ 1/T
Ans. V ∝ T
একই উষ্ণতা এবং একই চাপে সম আয়তনের সকল গ্যাসে সমান সংখ্যক অণু থাকে, এটি কার সূত্র ?
- চার্লস সূত্র
- বয়েল সূত্র
- অ্যাভােগাড্রো সূত্র
- বয়েল ও চার্লসের সংযােগসূত্র
Ans- অ্যাভােগাড্রো সূত্র
এক মােল আদর্শ গ্যাসের সমীকরণ কি ?
(A) PV = RT
(B) PV = 1/2KT
(C) PV = nKT
(D) PV = nRT
Ans- PV = RT
মােলার গ্যাস ধ্রুবকের একক কি ?
আর্গ K⁻¹মােল⁻¹
Cal K মােল ⁻¹
লিটার K⁻¹ মােল⁻¹
জুল K⁻¹ মােল
Ans-আর্গ K⁻¹মােল⁻¹
প্রমাণ চাপ কি ভাবে মাপা হয়?
- 0 K উষ্ণতায় 45° অক্ষাংশে
- 0°C উষ্ণতায় 45° অক্ষাংশে
- 0°C উষ্ণতায় 76° অক্ষাংশে
- 0 K উষ্ণতায় 76° অক্ষাংশে
Ans- 0 K উষ্ণতায় 45° অক্ষাংশে
এক মােল আদর্শ গ্যাসের PV/RTএর মান কত ?
- 1.0
- 8.315
- 0.7
- 0.086
Ans- 1.0
বয়েল ও চার্লস সূত্রের সাধারণ ধ্রুবকটি কি ?
- গ্যাসের চাপ
- গ্যাসের উষ্ণতা
- গ্যাসের আয়তন
- গ্যাসের ভর
Ans- গ্যাসের ভর
8 g o CH, এবং 2 g H,-এর মিশ্রণটি 760 mm চাপে ও 273 K তাপমাত্রায় রয়েছে । এর আয়তন কত হবে ?
- 22.6 L
- 33.6 L
- 44.4L
- 11.4 L
Ans- 33.6 L
Short Questions – of Gaser Acharon – গ্যাসের আচরণ 2-3 marks
বাস্তব গ্যাস ও আদর্শ গ্যাস বলতে কী বােঝাে? বাস্তব গ্যাসগুলি আদর্শ গ্যাসের সমীকরণ কী শর্তে মেনে চলে ?
ANS- বাস্তব গ্যাস : যেসব গ্যাস বয়েল ও চার্লসের সূত্র মেনে চলে না তাদের বাস্তব গ্যাস বলে । যেমন—অক্সিজেন, নাইট্রোজেন প্রভৃতি হলাে বাস্তব গ্যাস |
আদর্শ গ্যাস : যেসব গ্যাস যেকোনাে চাপ ও উষ্ণতায় বয়েল ও চার্লসের সূত্র মেনে চলে তাকে আদর্শ গ্যাস বলে । যদিও আদর্শ গ্যাস শুধু কল্পনা মাত্র, বাস্তবে এমন কোনাে গ্যাসের অস্তিত্ব নেই ।
বাস্তব গ্যাস উচ্চউষ্ণতা ও নিম্নচাপে আদর্শ গ্যাসের মতাে আচরণ করে ।
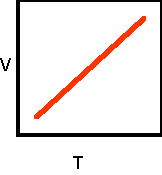
চার্লসের সূত্রটি পরম উষ্ণতার সাপেক্ষে প্রতিষ্ঠা করাে ও বিবৃত করাে । সূত্র অনুযায়ী V– T লেখচিত্র অঙ্কন করাে ।
ANS- 0সেন্টিগ্রেড উষ্ণতায় নির্দিষ্ট ভরের কোনাে গ্যাসের আয়তন v0হলে চার্লসের সূত্র অনুযায়ী, স্থির চাপে t° C উষ্ণতায় গ্যাসের আয়তন,
V=v0(1 + 1273)
বা, V = v0273 +T273 বা V = T273 v0
যেখানে T হলাে t°C উষ্ণতার পরম স্কেলের পাঠ ।
বা, V T [v0 = ধ্রুবক] ।
চার্লসের সূত্রের বিকল্প রূপটি হলাে – স্থির চাপে নির্দিষ্ট ভরের কোনাে গ্যাসের আয়তন গ্যাসটির পরম উষ্ণতার সমানুপাতিক ।
লেখচিত্র :
গ্যাস সংক্রান্ত বয়েলের সূত্রটি লেখাে ও ব্যাখ্যা করাে । লেখচিত্রের সাহায্যে এই সূত্রটি প্রকাশ করাে ।
ANS- বয়েলের সূত্র : উষ্ণতা স্থির থাকলে নির্দিষ্ট ভরের কোনাে গ্যাসের আয়তন এই গ্যাসের চাপের সঙ্গে ব্যস্তানুপাতে পরিবর্তিত হয় ।
ব্যাখ্যা , নির্দিষ্ট ভরের কোনাে গ্যাসের আয়তন V ও চাপ p হলে বয়েলের সূত্র অনুযায়ী V 1/p (যখন উষ্ণতা স্থির)
বা,V = k/p বা, pV= K
যেখানে K একটি ধ্রুবক ।
নির্দিষ্ট ভরের কোনাে গ্যাসের উষ্ণতা স্থির থাকলে p1 চাপে গ্যাসের আয়তন V1 এবং p1 চাপে গ্যাসের আয়তন V2 হলে বয়েলের সূত্র অনুযায়ী, P1V1 = P2V2,
লেখচিত্র :

কাকে সর্বজনীন গ্যাস ধ্রুবক বলে? কেন একে সর্বজনীন বলে ?
ANS- নির্দিষ্ট ভরের গ্যাসের ক্ষেত্রে, গ্যাসের চাপ ও আয়তনের গুণফলের সাথে কেলভিন স্কেলে উষ্ণতায় অনুপাত সর্বদা ধ্রুবক থাকে । এক গ্রাম অণু পরিমাণ গ্যাসের ক্ষেত্রে এই ধ্রুবককে সর্বজনীন গ্যাস ধ্রুবক বলে । একে মােলার গ্যাস ধ্রুবক ও বলা হয় ।
যেহেতু যেকোনাে গ্যাসের ক্ষেত্রে এই ধ্রুবক-এর মান সর্বদা সমান থাকে, তাই একে সর্বজনীন বলা হয় । সর্বজনীন গ্যাস ধ্রুবকের মান গ্যাসের ভর ও অবস্থা নির্ণয়কারী শর্তের ওপর নির্ভর করে না ।
গ্যাসের চাপের সঙ্গে ঘনত্বের সম্পর্কটি লেখাে ।
ANS- গ্যাসের চাপের সঙ্গে ঘনত্বের সম্পর্কটি হলাে— P = dRT 1 যেন P = চাপ, D = ঘনত্ব, R = সর্বজনীন গ্যাস ধ্রুবক, T = উষ্ণতা, M = আণবিক ভর, অর্থাৎ গ্যাসের চাপ ঘনত্বের সমানুপাতিক ।
উষ্ণতার পরম স্কেল কাকে বলে ?
ANS- পরমশূন্য অর্থাৎ -273° সেন্টিগ্রেডকে 0° ধরে যদি তাপমাত্রার প্রতি ডিগ্রিকে 1° সেন্টিগ্রেডের সমান হিসেবে মাপা হয় তাহলে তাপমাত্রার যে স্কেল পাওয়া যায় তাকে পরম স্কেল বলে , এবং পরম স্কেল অনুসারে তাপমাত্রার মানকে বলে পরম উষ্ণতা ।
আদর্শ গ্যাসের সমীকরণ থেকে দেখাও গ্যাসের ঘনত্ব d = PM/RT.
ANS- আদর্শ গ্যাসের সমীকরণ অনুসারে,
Long Questions – of Gaser Acharon – গ্যাসের আচরণ 5 marks
বায়ুমণ্ডলীয় চাপে এবং ঘরের উন্নতায় 16 Lবায়ুতে কতগুলি অণু আছে? ঘরের উন্নতা 27° C এবং R = 8.31 J. mol.K⁻¹

2 mol N₂ ও 2 mol NH₃-এর মধ্যে কোনটিতে পরমাণুর সংখ্যা বেশি?

STP-তে 8.4 L কোনাে গ্যাসে উপস্থিত অণুর সংখ্যা কত হবে?

27°c উষ্ণতায় ও 570 mm পারদস্তম্ভের চাপে 2.5g কার্বন ডাই-অক্সাইডের আয়তন কত?

1 আটমস্ফিয়ার চাপে ও 300 K উষ্ণতায় ৪ g H, গ্যাসের (H = 1) আমি কত হবে? |R = ANS-0.082 L. atm . mol⁻¹. k⁻¹]
![1 আটমস্ফিয়ার চাপে ও 300 K উষ্ণতায় ৪ g H, গ্যাসের (H = 1) আমি কত হবে? |R = ANS-0.082 L. atm . mol⁻¹. k⁻¹]](https://skillyogi.org/wp-content/uploads/2022/04/5-min.jpg)
STP-তে 11.2 LN₂ গ্যাসের ভর 14 g হলে N₂-এর মােলার ভর কত?

3টি O₂অণুর ভর কত?

0°C উষ্ণতায় রক্ষিত একটি নির্দিষ্ট ভরের গ্যাসের চাপ দ্বিগুণ ও আয়তন অর্ধেক করা হলাে। গ্যাসটির অন্তিম উষ্ণতা কত হবে?

কোনাে গ্যাসের 1 গ্রাম 7°C উয়তায় 2 অ্যাটমস্ফিয়ার চাপে 410 mL আয়তন অধিকার করে। গ্যাসটির মােলার ভর নির্ণয় করাে। (R = 0.082 L. atm .mol⁻¹. K⁻¹।

300 k উয়তা ও 3 atm চাপে কোনাে গ্যাসের ঘনত্ব 0.027 g/mL । গ্যাসটির মমালার ভর নির্ণয় করাে।

273°C উয়তায় 1.5 atm চাপে ৪ g হাইড্রোজেনের আয়তন নির্ণয় করাে। (R = 0.082 L atm mol⁻¹ K⁻¹)

একটি নির্দিষ্ট ভরের কোনাে গ্যাসের 90 cm Hg চাপে আয়তন 500 cm₃ হলে ওই উয়তায় এবং 60 cm Hg চাপে গ্যাসটির আয়তন কত হবে?

1 গ্রাম-অণু অক্সিজেন গ্যাসের চাপ 760 mm এবং আয়তন 22400 ml হলে ওই গ্যাসের তাপমাত্রা সেন্টিগ্রেডে কত? [R = 0.082 L atm mol⁻¹ K⁻¹]
![1 গ্রাম-অণু অক্সিজেন গ্যাসের চাপ 760 mm এবং আয়তন 22400 ml হলে ওই গ্যাসের তাপমাত্রা সেন্টিগ্রেডে কত? [R = 0.082 L atm mol⁻¹ K⁻¹]](https://skillyogi.org/wp-content/uploads/2022/04/13-min.jpg)