আপনি এখানে শিখবেন এই অধ্যায়ে এবং বিষয়ের ফাউন্ডেশন অংশটা, এই বিষয়টিকে সহজ-সরলভাবে পড়িয়েছেন বিশেষজ্ঞ শিক্ষক ভিডিও লেকচার এর মাধ্যমে এবং এই পুরো অধ্যায়কে চার ভাগে খন্ডিত করে আপনার জন্য তৈরি করা হয়েছে
প্রথম খন্ডে আপনি শিখবেন ফাউন্ডেশন অংশটা যেখানে অধ্যায়ের ব্যাপারে আপনাকে বোঝানো হয়েছে তার মানে definitions,basics গুলো সহজভাবে. এবং এটাকে আপনি বুঝতে পারবেন যেটা আপনাকে পরীক্ষার জন্য ক্রীপের করতে সাহায্য করবে
দ্বিতীয় মডিউলে আপনি শিখবেন MCQ মাল্টিপল চয়েস কোশ্চেন যেটা সাধারণত এক Marks’er আসে পরীক্ষায়
তৃতীয় মডিউলে আপনি শিখবেন শর্ট অ্যানসার এবং কোয়েশ্চেন, যেটা আপনার পরীক্ষার সাজেশন মধ্যে পড়ে এবং এটা 3-4 marks’er প্রশ্ন আসে আপনার পরীক্ষা
চতুর্থ মডিউল আপনি শিখবেন লং আনসার এবং questions যেটা সাধারণত 5-6 marks er হয়
আপনার যদি কোন প্রশ্ন থাকে তাহলে আমাদের সাথে যোগাযোগ করুন যাতে কি আপনাকে আমরা সাহায্য করতে পারি
Here you will learn the basics of CHAPTER 8 – পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ – PHYSICAL AND CHEMICAL PROPERTIES in a simple language it is for Bengali medium students who are studying under West Bengal Board of Secondary Education and preparing for their exam (Class 10 WBBSE) Here you will find all necessary and important WBBSE Madhyamik Suggestions, notes, solved sample question paper in Bangla along with video lectures from expert teachers
পর্যায় সারণি এবং মৌলদের ধর্মের পর্যায়বৃত্ততা :
পর্যায় সারণির ইতিহাস : 1827 খ্রিস্টাব্দে জার্মান বিজ্ঞানী ডোবেরাইনার তার সূত্র প্রকাশ করেন। এই সূত্রানুযায়ী ধর্মের সাদৃশ্য আছে এমন প্রতি তিনটি মৌলের মাঝের মৌলটির পারমাণবিক গুরুত্ব মোটামুটি ভাবে অপর মৌলটির পারমাণবিক গুরুত্বের গড় হয় ।Li(7),Na(23),K(39) এই তিনটি মৌল সাদৃশ্য ধর্মী। Na এর পারমাণবিক গুরুত্ব= 7+392+23 কিন্তু বিশেষ কয়েকটি মৌল ছাড়া এই সূত্র মান্যতা পায় না।
1862 খ্রিস্টাব্দে বিজ্ঞানী সাকুর্তোয়া কুন্ডলীর সূত্র এবং ন 1864 খ্রিস্টাব্দে বিজ্ঞানী নিউল্যান্ডস অষ্টক সূত্র প্রকাশ করেন। 1869 খ্রিস্টাব্দে রাশিয়ান বিজ্ঞানী মেন্ডেলিভ মৌলগুলির পারমাণবিক ওজন , ঘনত্ব, গলনাঙ্ক, স্ফুটনাঙ্ক এইসব ভৌতধর্ম এবং রাসায়নিক ধর্ম সংক্রান্ত বিভিন্ন পরীক্ষালবদ্ধ তথ্যের ভিত্তিতে পর্যায় সূত্র ও পর্যায় সারণি প্রকাশ করেন। আবার 1870 খ্রিস্টাব্দে জার্মান বিজ্ঞানী লোথার পারমাণবিক আয়তনের উপর ভিত্তি করে পর্যায় সারণি প্রকাশ করেন।এজন্য 1882 খ্রিস্টাব্দে দুজনকেই ডেভি মেডেল প্রদান করে সম্মানিত করা হয়।
মেন্ডেলিভের পর্যায় সূত্র :
বিভিন্ন মৌলের ভৌত এবং রাসায়নিক ধর্মগুলি ওদের পারমাণবিক ভর বাড়ার সঙ্গে সঙ্গে পর্যায়ক্রমে পুনরাবৃত্ত হয় ।
মেন্ডেলিভের পর্যায় সারণি :
মেন্ডেলিভ তাঁর সময় পর্যন্ত জানা 63 টি মৌলকে তাদের ধর্ম অনুযায়ী সাজিয়ে 1869 খ্রিস্টাব্দে যে সারণি প্রকাশ করেন ,তাকে মেন্ডেলিভের পর্যায় সারণি বলে।তিনি1871 খ্রিস্টাব্দে সারণিটিকে পরিবর্তিত আকারে প্রকাশ করেন।
মেন্ডেলিভ মৌলগুলিকে ক্রমবর্ধমান পারমাণবিক গুরুত্ব অনুযায়ী সাজানোর নীতি গ্রহণ করলেও কোনো কোনো ক্ষেত্রে পারমাণবিক মৌলগুলির ওজন অপেক্ষা, ভৌত ও রাসায়নিক ধর্মের পরৃযায়বৃত্ততাকেই অধিকতর গুরুত্ব প্রদান করেন।
পারমাণবিক সংখ্যার ভিত্তিতে সংক্ষিপ্ত পর্যায় সারণি।
মৌলের চিহ্নের পাশের ও নীচের সংখ্যা গুলো যথাক্রমে পরমাণু ক্রমাঙ্ক ও পারমাণবিক গুরুত্ব নির্দেশ করে।(CAS পদ্ধতি অনুযায়ী)

আধুনিক IUPAC দীর্ঘ পর্যায় সারণি(মৌলের চিহ্নের লিখিত সংখ্যা পরমাণু ক্রমাঙ্ক নির্দেশ করে।
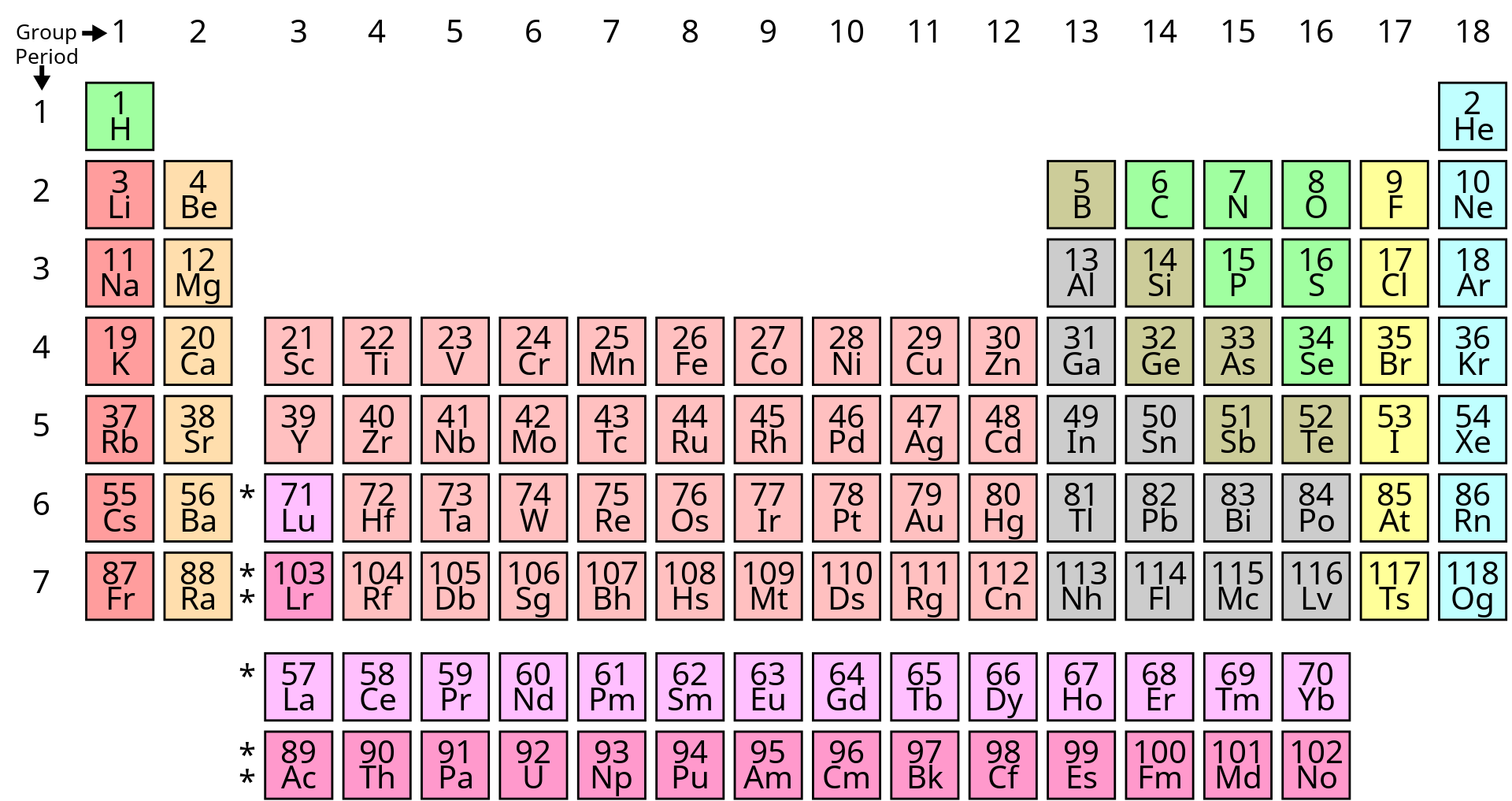
আধুনিক পর্যায় সারণি :
আইসোটেপ আবিস্কার হওয়ার পর জানা যায় যে একই মৌলের অভিন্ন রাসায়নিক ধর্মযুক্ত এবং বিভিন্ন পারমাণবিক ভরযুক্ত একাধিক পরমাণু থাকতে পারে।তাই মেন্ডেলিভের পর্যায় সূত্রটিকে সংশোধিত আকারে প্রকাশ করা হয়।
মেন্ডেলিভের সংশোধিত আধুনিক পর্যায়সূত্র :
বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্মগুলি ওদের ক্রমবর্ধমান পারমাণবিক সংখ্যার সঙ্গে পর্যায়ক্রমে পুনরাবৃত্ত হয় । নীলস্ বোর আধুনিক সর্যায়সূত্রের সঙ্গে সামঞ্জস্য রেখে ইলেকট্রন বিন্যাসের উপর ভিত্তি করে এই পর্যায়সারণি রচনা করেন।1988 খ্রিস্টাব্দে IUPAC সংস্থা নতুনভাবে শ্রেণিগুলির নামকরণ করেন।
শ্রেণী ও পর্যায় :
ইলেকট্রন বিন্যাসের পর্যায়ক্রমিক পুনরাবৃত্তির জন্য তাদের রাসায়নিক ধর্মও পর্যায়ক্রমে পরিবর্তিত হয় এবং পুনরাবৃত্তি ঘটে।সদৃশ ধর্মযুক্ত মৌলগুলিকে উলম্বভাবে সাজানো হয়।এভাবে কতকগুলি অনুভুমিক সারি ও উলম্ব স্তম্ভ পাওয়া যায়। অনুভূমিক সারিতে ইলেকট্রনের কক্ষপথের সংখ্যা একই থাকে কিন্তু সর্ববহিস্থ কক্ষে ইলেকট্রনের সংখ্যা বৃদ্ধি পায়।
উলম্ব স্তম্ভে ইলেকট্রনের কক্ষপথের সংখ্যা ক্রমশ বৃদ্ধি পায় এবং সর্ববহিস্থ কক্ষে ইলেকট্রন সংখ্যা সমান থাকে।পর্যায় সারণিতে উলম্বভাবে অবস্থিত মৌলগুলির স্তম্ভকে শ্রেণি বলা হয় এবং অনুভূমিক অবস্থিত মৌলগুলির সারণিকে পর্যায় বলা হয়। বর্তমানে ক্ষুদ্র পর্যায় সারণিতে 7 টি পর্যায় এবং9 টি শ্রেণি পাওয়া যায়।দীর্ঘ পর্যায় সারণিতে 7 টি পর্যায় ও 18 টি শ্রেণি পাওয়া যায়।
পর্যায় সারণিতে কতকগুলি বিশেষ মৌলের অবস্থান:
1) ক্ষার ধাতু : মেন্ডেলিভের পর্যায়সারণিতে 1 -এ অবস্থিত Li,Na,K,Rb,Cs,Fr ধাতুগুলি হল ক্ষার ধাতু।জলের সাথে তীব্র বিক্রিয়া করে এগুলি উৎপন্ন হয়।
2) ক্ষারীয় মৃত্তিকা ধাতু : মেন্ডেলিভের পর্যায়সারণিতে 2 -এ অবস্থিত Be,M g,Ca,Sr,Ba এগুলিকে ক্ষারীয় ধাতু বলে।অক্সাইড জলের সাথে বিক্রিয়া করে এগুলি উৎপন্ন হয়।
3) হ্যালোজেন মৌল : মেন্ডেলিভের পর্যায়সারণিতে 17-এ অবস্থিত F,Cl,Br,l,At এগুলি হল হ্যালোজেন মৌল।সমুদ্রের জলে দ্রবীভূত হয়ে এগুলি পাওয়া যায়।তাই এদের সামুদ্রিক লবণ উৎপাদক মৌল ও বলা হয়।
4) নিস্ক্রিয় গ্যাস বা নোবেল গ্যাস : মেন্ডেলিভের পর্যায়সারণি তৈরীর সময় এই মৌলগুলি আবিস্কৃত হয় নি,পরে আবিস্কৃত হওয়ায় এদের স্থান Gr 0 তে দেওয়া হয় ।দীর্ঘ পর্যায়সারণিতে 18 এ বসানো হয়।মৌলগুলি হল He,Ne,Ar,Kr,Xe,Rn।
5) সন্ধিগত মৌল: পর্যায় সারণিতে চতুর্থ পর্যায়ে অবস্থিত Sc(21) থেকে Cu(29) পর্যন্ত 9 টি মৌল এবং পঞ্চম পর্যায়ে অবস্থিত Y(39)থেকে Ag(47) পর্যন্ত 9টি মৌলকে প্রথম ও দ্বিতীয় সন্ধিগত মৌল বলা হয়।
6) ইউরেনিয়ামোত্তর মৌল : সপ্তম পর্যায়ে Fr(87)থেকেU(92) পর্যন্ত ছয়টি মৌল প্রাকৃতিক।ইউরেনিয়ামের পরবর্তী মৌল গুলি পরীক্ষাগারে কৃত্তিমভাবে তৈরি এগুলিই হল ইউরেনিয়ামোত্তর মৌল।
পর্যায়সারণিতে হাইড্রোজেনের অবস্থান : পর্যায়সারণিতে হাইড্রোজেনের অবস্থান নিয়ে বিতর্ক আছে। গ্রুপ 1 এর ক্ষারধাতুর সঙ্গে গ্রুপ 17 হ্যালোজেন মৌল সাথে হাইড্রোজেনে এর সাদৃশ্য ও বৈসাদৃশ্য লক্ষ করা যায়।
ক্ষারধাতুর সঙ্গে সাদৃশ্য : ক্ষারধাতুর মত হাইড্রোজোনের যোজ্যতা 1 এবং ক্ষারধাতুর মত বিজারক পদার্থ।
ক্ষারধাতুর সঙ্গে পার্থক্য : ক্ষার হল ধাতু কিন্তু হাইড্রোজেন অধাতু এবং ক্ষারধাতু উষ্ণতায় কঠিন কিন্তু হাইড্রোজেন উষ্ণতায় গ্যাসীয়।
হ্যালোজেনের সঙ্গে সাদৃশ্য : হ্যালোজেন মৌল গ্যাসীয় অধাতু ও দ্বিপরমাণুবিক এবং হাইড্রোজেন ও গ্যাসীয় অধাতু ও দ্বিপরমাণুবিক।
হ্যালোজেনের সঙ্গে পার্থক্য : হাইড্রোজেন তীব্র বিজারক পদার্থ কিন্তু হ্যালোজেন তীব্র জারক পদার্থ।
মৌলসমূহের ধর্মের পর্যায়বৃত্ততা : মৌলগুলির পরমাণু ক্রমাঙ্ক বৃদ্ধির সাথে সাথে ইলেকট্রন বিন্যাসের পার্থক্য ঘটে এবং নির্দিষ্ট ব্যবধানের পর পুনরাবৃত্তিও ঘটে। বিভিন্ন ধর্মের ভৌত ও রাসায়নিক ধর্মের পর্যায়ক্রমিক পুনরাবৃত্তিকে ধর্মের পর্যায়বৃত্ততা বলা হয়। নীচে উদাহরণ দেওয়া হল।
1) পারমাণবিক ব্যাসার্ধ:-কোন মৌলের পরমানুর নিউক্লিয়াস থেকে সর্বশেষ ইলেকট্রনের কক্ষপথ পর্যন্ত দূরত্বকে পারমাণবিক ব্যাসার্ধ বলে। একই পর্যায়ের বাম থেকে ডান দিকে গেলে মৌলের পারমাণবিক ব্যাসার্ধ হ্রাস পায় এবং একই গ্রুপের উপর থেকে নিচের দিকে আসলে পারমাণবিক ব্যাসার্ধ বৃদ্ধি পায়।
2) আইনাইজেশন শক্তি:-কোনো মৌলের বিচ্ছিন্ন , গ্যাসীয় পরমাণু থেকে তার যোজ্যতা কক্ষের সবচেয়ে দুর্বলভাবে আবদ্ধ ইলেকট্রনকে অপসারিত করে পরমাণুটিকে গ্যাসীয় অবস্থায় এক একক ধনাত্মক আধানবিশিষ্ট ক্যাটায়নে পরিণত করার জন্য প্রয়োজনীয় নূন্যতম শক্তিকে ওই মৌলের আয়নাইজেশন শক্তি বলে। একই পর্যায়ের বাম থেকে ডানে দিকে অগ্রসর হলেআইনাইজেশন শক্তি এর মান বৃদ্ধি পায়। একই শ্রেণীর ওপর থেকে নিচে গেলে আইনাইজেশন শক্তি হ্রাস পায়।
3) তড়িৎ ঋণাত্মকতা (Electronegativity):-অন্য কোনো মৌলের পরমাণুর সঙ্গে সমযোজী বন্ধনে আবদ্ধ অবস্থায় বন্ধন সৃষ্টিকারী ইলেকট্রন জোড়কে মৌলের পরমাণুর নিজের দিকে আকর্ষণ করার ক্ষমতাকে ভড়িৎ ঋণাত্মকতা বলে। পর্যায়ে তড়িৎ ঋণাত্মকতা বামদিক থেকে ডানদিকে বৃদ্ধি পায়। শ্রেণীতে ওপর থেকে নীচে হ্রাস পায়।
4) জারণ ও বিজারণ ধর্ম : কোনো মৌলের পরমাণু ইলেকট্রন বর্জন করে ক্যাটায়নে পরিণত হলে জারণ এবং ইলেকট্রণ গ্রহণ করে অ্যানায়নে পরিণত হলে বিজারণ।
Na – e 🠒 Na⁺ (জারণ),Cl+e 🠒 Cl⁻ (বিজারণ)
পর্যায়ে জারণ ক্ষমতা বামদিক থেকে ডানদিকে বৃদ্ধি পায়।বিজারণ ক্ষমতা ডানদিক থেকে বামদিকে বৃদ্ধি পায়। শ্রেণিতে জারণ ক্ষমতা নীচ থেকে ওপরে বৃদ্ধি পায়।বিজারণ ক্ষমতা ওপর থেকে নীচে বৃদ্ধি পায়।
আয়নীয় ও সমযোজী বন্ধন (Ionic and covalent bonding):
রাসায়নিক বন্ধন: কোনো মৌলিক বা যৌগিক অণু অথবা আয়নীয় জোটে অংশগ্রহণকারী একই বা ভিন্ন মৌলের পরমাণুগুলি নির্দিষ্ট আকর্ষণী বলের দ্বারা সংযুক্ত থাকে।পরমাণু গুলির যোজ্যতা কক্ষে ইলেকট্রন গুলির পুনর্বিন্যাসের ফলে সৃষ্ট আকর্ষণ বলের দ্বারা পরমাণু বা আয়ন গুলি আবদ্ধ হয়ে আবদ্ধ হয়ে অপেক্ষাকৃত বেশি স্থায়িত্ব অর্জন করে । এর ফলে বিভিন্ন আয়নীয় জোট গঠিত হয় এই আকর্ষণ বল কে রাসায়নিক বন্ধন বলা হয়। হিলিয়াম, নিয়ন ,আর্গন ,ক্রিপটন ,জেনন এবং রেডন 6 টি মৌলের ইলেকট্রন বিন্যাস খুবই সুস্থিত।
আয়নীয় যৌগ গুলির ধর্ম : আয়নীয় যৌগ গুলির গলনাঙ্ক ও স্ফুটনাঙ্ক বেশি হয়। এগুলি সাধারণ উষ্ণতায় কঠিন পদার্থ।। এগুলি কঠিন অবস্থায় তড়িৎ পরিবহন করে না কিন্তু গলিত অবস্থায় তড়িৎ পরিবহন করে আয়নীয় যৌগ গুলি ধ্রুবীয় দ্রাবকে দ্রবীভূত হয়। এই যৌগ গুলির রাসায়নিক বিক্রিয়া সরল প্রকৃতির এবং একমুখী।
আয়নীয় বন্ধন : পরমাণু গুলির মধ্যে ইলেকট্রন বর্জন এবং গ্রহণ এমনভাবে সংগঠিত হয় যাতে প্রত্যেকটি পরমাণু পর্যায় সারণিতে অবস্থিত তার নিকটতম নোবেল গ্যাসের স্থায়ী ইলেকট্রন বিন্যাস লাভ করতে পারে ।ক্যাটায়ন ও অ্যানায়ন গুলির মধ্যে স্থির তড়িৎ আকর্ষণ বলের প্রভাবে স্থায়ী আয়নীয় বা তড়িৎযোজী বন্ধন সৃষ্টি হয়। এভাবে যে যৌগ উৎপন্ন হয় তাকে আয়নীয় বা তড়িৎযোজী যৌগ বলা হয়।কোন মৌলের একটি পরমাণু যতগুলি ইলেকট্রন বর্জন বা গ্রহণ করে সেই সংখ্যার দ্বারা ঐ মৌলের তড়িৎ যোজ্যতা পরিমাপ করা হয়।
1) সোডিয়াম ক্লোরাইড (NaCl) : সোডিয়াম ক্লোরাইড আয়নীয় যৌগ এই যৌগ গঠনে সোডিয়াম পরমাণু একটি ইলেকট্রন ত্যাগ করে এবং ক্লোরিন পরমাণুর ইলেকট্রন গ্রহণ করে ।সুতরাং সোডিয়ামের তড়িৎ যোজ্যতা 1এবং ক্লোরিনের তড়িৎ যোজ্যতা 1।
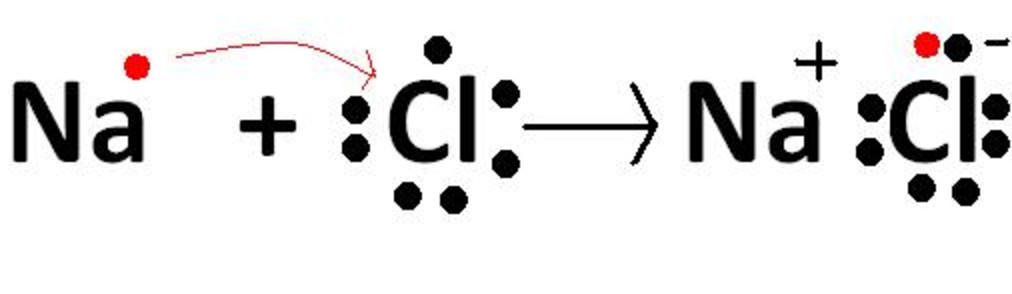
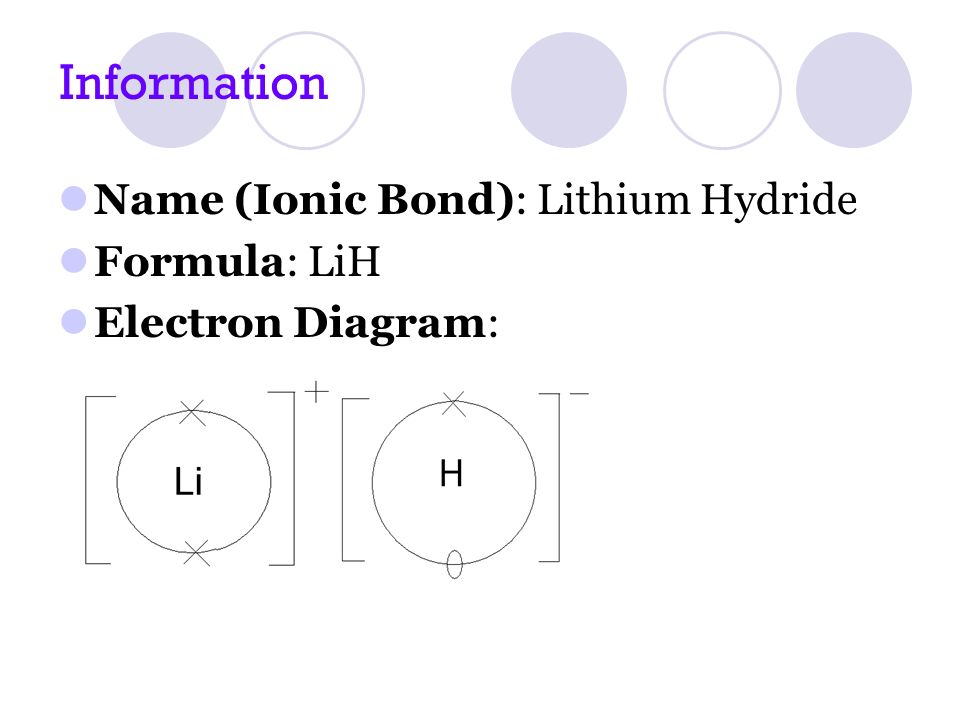
2) লিথিয়াম হাইড্রাইডের গঠন (Lih) : লিথিয়াম পরমাণুর যোজ্যতা কক্ষের 1 টি ইলেকট্রন হাইড্রোজেন পরমাণুর যোজ্যতা কক্ষে স্থানান্তরিত হওয়ার পর লিথিয়াম হাইড্রাইড গঠিত হয়।Li এর যোজ্যতা 1 h এর যোজ্যতা 1।
3) ক্যালসিয়াম অক্সাইড(CaO) : ক্যালসিয়াম পরমাণুর যোজ্যতা কক্ষের 2 টি ইলেকট্রন পরমাণুর যোজ্যতা কক্ষে স্থানান্তরিত হওয়ার ফলে CaO উৎপন্ন হয়।এর যোজ্যতা 2।
4) ম্যাগনেশিয়াম ক্লোরাইড(Mgcl2) : ম্যাগনেশিয়ামের একটি পরমাণুর যোজ্যতা কক্ষের 2 টি ইলেকট্রন ক্লোরিনের দুটি পরমাণুর প্রত্যেকটির যোজ্যতা কক্ষে 1 টি করে ইলেকট্রন স্থানান্তরিত হওয়ার ফলে এই যৌগ গঠিত হয়।Mg এর যোজ্যতা 2 এবং Cl এর 1।
5) সোডিয়াম ফ্লুরাইড (NaF) : সোডিয়াম পরমাণুর যোজ্যতা কক্ষের 1 টি ইলেকট্রন ফ্লুওরিন পরমাণুর যোজ্যতা কক্ষে স্থানান্তরিত হওয়ার ফলে এটি গঠিত হয়। উভয়ের যোজ্যতা1।
3) ক্যালসিয়াম অক্সাইড(CaO) : ক্যালসিয়াম পরমাণুর যোজ্যতা কক্ষের 2 টি ইলেকট্রন অক্সিজেন পরমাণুর যোজ্যতা কক্ষে স্থানান্তরিত হওয়ার ফলে CaO উৎপন্ন হয়।এর যোজ্যতা 2।
2) লিথিয়াম হাইড্রাইডের গঠন (Lih) : লিথিয়াম পরমাণুর যোজ্যতা কক্ষের 1 টি ইলেকট্রন হাইড্রোজেন পরমাণুর যোজ্যতা কক্ষে স্থানান্তরিত হওয়ার পর লিথিয়াম হাইড্রাইড গঠিত হয়।Li এর যোজ্যতা 1 h এর যোজ্যতা 1।
4) ম্যাগনেশিয়াম ক্লোরাইড(Mgcl2) : ম্যাগনেশিয়ামের একটি পরমাণুর যোজ্যতা কক্ষের 2 টি ইলেকট্রন ক্লোরিনের দুটি পরমাণুর প্রত্যেকটির যোজ্যতা কক্ষে 1 টি করে ইলেকট্রন স্থানান্তরিত হওয়ার ফলে এই যৌগ গঠিত হয়। Mg এর যোজ্যতা 2 এবং Cl এর 1।

5) সোডিয়াম ফ্লুরাইড (NaF) : সোডিয়াম পরমাণুর যোজ্যতা কক্ষের 1 টি ইলেকট্রন ফ্লুওরিন পরমাণুর যোজ্যতা কক্ষে স্থানান্তরিত হওয়ার ফলে এটি গঠিত হয়। উভয়ের যোজ্যতা1।

সমযোজী যৌগের ধর্ম : সমযোজী যৌগ গুলি সাধার উষ্ণতায় গ্যাসীয় তরল পদার্থ হিসাবে থাকে। গলনাঙ্ক স্ফুটনাঙ্ক কম। এই যৌগের অণুগুলি তড়িৎ পরিবহন করে না। জলে দ্রবীভূত হয় না । বিক্রিয়া অতি ধীর গতিতে হয়। এই যৌগের সমাবয়তা ধর্ম দেখা যায়।
সমযোজী বন্ধন : দুটি পরমাণুর প্রত্যেকটি থেকে আগত সমসংখ্যক ইলেকট্রন দিয়ে গঠিত এক বা একাধিক ইলেকট্রন জোড় ওই দুটি পরমাণুর মধ্যে সমভাবে ব্যবহৃত হওয়ার ফলে যে রাসায়ণিক বন্ধনের সৃষ্টি হয় তাকে সমযোজী বন্ধন বলে। সমযোজী বন্ধন তিন প্রকার-সমযোজী এক বন্ধন,সমযোজী দ্বি বন্ধন,সমযোজী ত্রিবন্ধন।
সমযোজী অণু : একই মৌলের পরমাণুগুলির মধ্যে সমযোজী বন্ধনের দ্বারা উৎপন্ন যৌগের অণুকে সমযোজী অণু বলে। সমযোজী অণু দুই প্রকার-মৌলের অণু ও যৌগের অণু।
তড়িৎপ্রবাহ ও রাসায়নিক বিক্রিয়া :
তড়িৎবিশ্লেষ্য পদার্থ:-অ্যাসিড,ক্ষার ও লবণ বিগলিত অবসথায় বা জলীয় দ্রবণে বিপরীত তড়িৎদাধানযুক্ত আয়নে বিয়োজিত হয় এবং এই আয়নগুলির সাহায্যে তড়িৎ পরিবহণ করে একে তড়িৎবিশ্লেষ্য পদার্থ বলে। উদাহরণ:-অ্যাসিড,লবণ।
তড়িৎ অবিশ্লেষ্য পদার্থ : যেসব যৌগ বিগলিত অবস্থায় তড়িৎ পরিবহণ করে না তাদের তড়িৎ অবিশ্লেষ্য পদার্থ বলে। উদাহরণ- চিনির জলীয় দ্রবণ, ইথানল।
তীব্র ও মৃদু তড়িৎবিশ্লেষ্য :
যেসব যৌগ জলীয় দ্রবণে প্রায় সম্পূর্ণরূপে বিপরীত তড়িৎযুক্ত আয়নে বিয়োজিত হয়, একে তীব্র তড়িৎবিশ্লেষ্য বলে। যেমন-HCL
যেসব যৌগ জলীয় দ্রবণে আংশিক ভাবে বিপরীত তড়িৎযুক্ত আয়নে বিয়োজিত হয়, তাকে মৃদু তড়িৎবিশ্লেষ্য বলে।যেমন-HCOOH
তড়িৎবিশ্লেষ্য পদার্থ কীভাবে তড়িৎ পরিবহন করে :
ধাতুগুলি সাধারণত কঠিন অবস্থায় মুক্ত ইলেকট্রণের সাহায্যে তড়িৎপরিবহন করে ।তড়িদ্ বিশ্লেষ্যগুলি জলের মত উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থায় বিয়োজিত আয়নগুলির সাহায্যে তড়িৎ পরিবহন করে।
তড়িৎ বিশ্লেষণ :
বিগলিত বা উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থায় তড়িদ্বিশ্লেষ্য পদার্থের ভিতর দিয়ে তড়িৎপ্রবাহ পরিচালিত করে নির্দিষ্ট দ্বারে পদার্থটির রাসায়নিক বিয়োজন ঘটানোর পদ্ধতিকে তড়িদ্বিশ্লেষণ বলা হয়।
তড়িৎ বিশ্লেষণ কোশ বা ভোল্টামিটার (Voltameter) :
বিগলিত বা উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থায় তড়িৎবিশ্লেষ্য পদার্থকে যে পাত্রে রেখে তড়িদ্ বিশ্লেষণ করা হয় তাকে তড়িদ্ বিশ্লেষণ কোশ বা ভোল্টামিটারবলে।
অ্যানোড ও ক্যাথোড : ব্যাটারির ধনাত্মক মেরুর সঙ্গে যুক্ত তড়িৎদ্বারে অ্যানায়নগুলি ইলেকট্রন বর্জন করে জারিত হয় একেই বলে অ্যানোড। ব্যাটারির ঋনাত্মক মেরুর সঙ্গে যুক্ত তড়িৎদ্বারে ক্যাটায়ন গুলি ইলেকট্রন গ্রহণ করে বিজারিত হয় একে ক্যাথোড বলে।
তড়িদ্বার : ভোল্টামিটারে দুটি দুটি সুপরিবাহী ধাতব পাত বা দন্ড আংশিক ভাবে নিমজ্জিত থাকে,এই পাত দুটি ধনাত্মক ও ঋণাত্মক মেরুর সঙ্গে যোগ করা হয় একে তড়িদ্বার বলে।
তড়িৎ বিশ্লেষণের প্রয়োগ :
1) ধাতু নিষ্কাশন : Na,K,Ca,Mg,Al প্রভৃতি তীব্র তড়িৎ ধনাত্মক ধাতু তড়িদ্ বিশ্লেষণ পদ্ধতিতে নিষ্কাশন করা হয়।
2) ধাতু পরিশোধন : কপার,আ্যালুমিনিয়াম প্রভৃতি ধাতু তড়িদ্ বিশ্লেষণ পদ্ধতিতে পরিশোধন করা হয়।
3) তড়িৎ লেপন(electroplating) : তড়িৎ রাসায়নিক পদ্ধতিতে কোনো নিকৃষ্ট মানের ধাতব বস্তুটিকে নিকৃষ্ট মানের ধাতু বা সংকর ধাতু নির্মিত বস্তুর উপর তড়িদ্ বিশ্লেষণের সাহায্যে কোনো উৎকৃষ্ট মানের ধাতুর নিরবিচ্ছিন্ন অতি পাতলা সুষম আস্তরণ দেওয়ার পদ্ধতিকে তড়িৎ লেপন বলে।
পরীক্ষাগার ও রাসায়নিক শিল্পে অজৈব রসায়ণ :
অ্যামোনিয়া প্রস্তুতির সাধারণ নীতি : যে কোনো অ্যামোনিয়াম লবণের সাথে যে কোনো ক্ষারক বা ক্ষার উত্তপ্ত করলে অ্যামোনিয়া গ্যাস উৎপন্ন হয়।
2NH₄Cl + Ca(OH)₂ 🠒 CaCl₂+2NH₃↑ + 2H₂O;
(NH₄)2SO₄+2NaOH 🠒 Na₂SO₄+2NH₃↑ + 2H₂O
অ্যামোনিয়া শুষ্ককরণের নীতি: কোনো আর্দ্র গ্যাস শুষ্ক করার সময় এমন পদার্থ নির্বাচন করা উচিত যাতে তারা পরস্পরের সাথে বিক্রিয়া না করে । ভিন্নধর্মী দুটি পদার্থের মধ্যেই রাসায়নিক বিক্রিয়া ঘটে থাকে। কাজেই একই ধর্মযুক্ত শোষক পদার্থ এই কাজে ব্যবহার করা উচিত।অ্যামোনিয়া ক্ষারকীয় গ্যাস ও পোড়াচুন ক্ষারকীয় জলশোষক পদার্থ । এজন্য পোড়াচুনের ভিতর দিয়ে আর্দ্র অ্যামোনিয়া গ্যাস প্রবাহিত করে অ্যামোনিয়া শুষ্ক করা হয় ।
অ্যামোনিয়ার ধর্ম :
অ্যামোনিয়ার ভৌত ধর্ম : অ্যামোনিয়া বিশেষ ঝাঁঝালো যুক্ত বর্ণহীন গ্যাস, বাতাসের চেয়ে হালকা। অ্যামোনিয়া জলে অতিমাত্রায় দ্রবণীয়। অ্যামোনিয়ার সম্পৃক্ত জলীয় দ্রবণকে লিকার অ্যামোনিয়া বলা হয়।
অ্যামোনিয়ার রাসায়নিক ধর্ম : এটি ক্ষারকীয় গ্যাস । অ্যামোনিয়া গ্যাস লাল লিটমাস দ্রবণকে নীল বর্ণে পরিণত করে । অ্যাসিডের সাথে বিক্রিয়ায় অ্যামোনিয়াম লবণ উৎপন্ন হয় । নাইট্রিক অ্যাসিডের ভেতর দিয়ে অ্যামোনিয়া গ্যাস পাঠালে অ্যামোনিয়াম নাইট্রেট লবণ উৎপন্ন হয় এবং সালফিউরিক অ্যাসিডের ভেতর দিয়ে অ্যামোনিয়া গ্যাস পাঠালে অ্যামোনিয়াম সালফেট লবণ উৎপন্ন হয় ।
অ্যামোনিয়া ও ইউরিয়ার প্রধান ব্যবহার ও শিল্পপ্রস্তুতি :
অ্যামোনিয়ার শিল্পপ্রস্তুতি : হেবার পদ্ধতিতে নাইট্রোজেন ও হাইড্রোজেনের সরাসরি বিক্রিয়া ঘটিয়ে শিল্পের জন্য অ্যামোনিয়া প্রস্তুত করা হয়।
অ্যমোনিয়ার প্রধান ব্যবহার : নাইট্রিক অ্যাসিড প্রস্তুতিতে,বরফ উৎপাদনে,ইউরিয়া সারের পণ্য উৎপাদনে,প্লাসটিক উৎপাদনে,কৃত্রিম রবার উৎপাদনে ব্যবহার হয়।
ইউরিয়ার শিল্পপ্রস্তুতি : অতিরিক্ত পরিমাণ নির্জল তরল অ্যামোনিয়া ও তরল কার্বষ ডাই অক্সাইড 150গুণ বায়ুমন্ডলীয় চাপে 200℃ উষ্ণতায় উত্তপ্ত করে ইউরিয়া তৈরি হয়।
ইউরিয়ার ব্যবহার : কৃষিক্ষেত্রে জৈব সার হিসাবে,কালাজ্বরের ওষুধ,ঘুমের ওষুধ ও অনান্য ওষুধ তৈরিতে ব্যবহার হয়।
হাইড্রোজেন সালফাইডের প্রস্তুতি :
নীতি:-পরীক্ষাগারে ফেরাস সালফাইডের সাথে সাধারণ উষ্ণতায় লঘু সালফিউরিক অ্যাসিডের বিক্রিয়ায় হাইড্রোজেন সালফাইড উৎপন্ন হয়। এক্ষেত্রে লঘু সালফিউরিক অ্যাসিড ব্যবহার করতে হবে এবং ঘরের উষ্ণতা থাকতে হবে। এটি মৃদু অম্লধর্মী গ্যাস । তাই বিশুদ্ধ পেন্টক্সাইডের ভিতর দিয়ে পাঠিয়ে এই গ্যাস শুষ্ক করা হয় । হাইড্রোজেন সালফাইড বায়ুদূষক গ্যাস এবং বিষাক্ত । এই গ্যাস বেশি পরিমাণে শরীরে প্রবেশ করলে মারাত্মক ক্ষতি হয়। এজন্য গ্যাসটি প্রস্তুত করার সময় যন্ত্রপাতি বায়ুনিরুদ্ধ রাখতে হবে এবং সাবধানতা অবলম্বন করতে হবে।
হাইড্রোজেন সালফাইডের ধর্ম:
ভৌত ধর্ম : পচা ডিমের গন্ধযুক্ত বিষাক্ত বর্ণহীন গ্যাস। বাতাসের তুলনায় 1.2 গুণ ভারী। গ্যাসটি ঠান্ডা জলে দ্রবণীয় কিন্তু গরম জলে অদ্রবণীয়।
রাসায়নিক ধর্ম : জলীয় দ্রবণে এটি মৃদু অম্লধর্মী। তীব্র ক্ষারের সঙ্গে বিক্রিয়ায় বাইসালফেড এবং সালফাইড লবণ উৎপন্ন করে। হ্যালোজেন, সালফার ডাইঅক্সাইড, ফেরিক ক্লোরাইড, প্রভৃতি তীব্র জারক পদার্থের জলীয় দ্রবণে হাইড্রোজেন সালফাইড পাঠালে এগুলি বিজড়িত হয় এবং হাইড্রোজেন সালফাইড সালফার জড়িত হয়। এই গ্যাস নিজে দাহ্য কিন্তু দহনে সহায়তা করেনা। অক্সিজেনে এটি নীল শিখায় জ্বলে।
নাইট্রোজেন প্রস্তুতি : দীর্ঘনল ফানেল ও নির্গম ফানেলে সোডিয়াম নাইট্রাইট ও অ্যামোনিয়াম ক্লোরাইডের জলীয় দ্রবণ নেওয়া হয়।নির্গমনলকে তরজালির উপরে রেখে আটকানো হয় এবং দীর্ঘনল ফানেলকে গ্যাসদ্রোণীর মধ্যে থাকা মধুকোশ পীঠের নীচে রাখা হয়।ফ্লাস্কটিকে বুনসেন বার্নারের সাহায্যে ধীরে ধীরে উত্তপ্ত করে নাইট্রোজেন উৎপন্ন হয়।
নাইট্রোজেনের ব্যবহার : অ্যামোনিয়া, নাইট্রিক অ্যাসিড প্রভৃতি পদার্থের পণ্য উৎপাদনে, রাসায়নিক নিস্ক্রিয়তার জন্য ইলেকট্রিক বাল্ব ও গ্যাস থার্মোমিটার পূর্ণ করার জন্য, তরল নাইট্রোজেনের হিমায়ক হিসাবে এবং কোনো কোনো রাসায়নিক বিক্রিয়ায় নিষ্ক্রিয় গ্যাস মাধ্যম হিসেবে কাজ করে ।
নাইট্রোজেনের ধর্ম : বর্ণহীন -গন্ধহীন-স্বাদহীন গ্যাস, বাতাসের চেয়ে সামান্য হালকা, জলে অদ্রাব্য।
SOLVED QUESTIONS & ANSWERS of পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ
1 MARKS QUESTIONS of পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ – PHYSICAL AND CHEMICAL PROPERTIES
- সন্ধিগত মৌল গুলির একটি বৈশিষ্ট্য লেখো ও উদাহরণ দাও |
Ans. সন্ধিগত মৌলের একটি বৈশিষ্ট্য হলো যে এরা রঙিন যৌগ গঠন করে | উদাহরণ- Cu, Zn |
- আধুনিক পর্যায় সূত্রটি ব্যাখ্যা করো |
Ans. বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্ম মৌল গুলির পারমানবিক সংখ্যা বৃদ্ধির সঙ্গে সঙ্গে পর্যায়ক্রমে পুনরাবৃত্তি হয় |
- পারমাণবিক ব্যাসার্ধ বলতে কী বোঝায় ?
Ans. পরমাণুর নিউক্লিয়াসের কেন্দ্র থেকে ইলেকট্রন এর সর্বশেষ অক্ষ এর দূরত্বকে পরমানবিক ব্যাসার্ধ বলে
- তড়িৎ ঋণাত্মক বলতে কী বোঝায় ?
Ans. অনু মধ্যস্থতায় কোন মৌলের পরমাণুর সমযোজী বন্ধন সৃষ্টিকারী ইলেকট্রন জোড় কে নিজের দিকে আকর্ষণ করার ক্ষমতাকে তড়িৎ ঋণাত্মকতা বলে |
- পর্যাবৃত্ততা বলতে কী বোঝো ? সংক্ষেপে লেখো |
Ans. পর্যায় সারণিতে দেখা যায় এক মৌল থেকে অন্য মৌলে নিয়মিতভাবে মৌলগুলির ভৌত রাসায়নিক ধর্ম আচার আচরণ পরিবর্তনের সঙ্গে সঙ্গে নির্দিষ্ট সংখ্যার ব্যবধানের পর সেই ধর্মের পুনরাবৃত্তি ঘটে | একই পর্যায়বৃত্ত বলা হয় |
- পর্যায় সারণিতে কিভাবে মৌলের জারণ ধর্ম পরিবর্তিত হয় ?
Ans. পর্যায় সারণিতে বাম দিক থেকে ডান দিকে গেলে শ্রেণীর সংখ্যা বৃদ্ধির সঙ্গে সঙ্গে জারণ ক্ষমতাও বৃদ্ধি পায় |
- নিকোজেন ও চালকোজেন মৌল কাকে বলে ?
Ans. 15 ও 16 নং মৌল গুলিকে যথাক্রমে নিকোজেন ও চালকোজেন মৌল বলে
- দুষ্ট মৌল কোন মৌলকে বলা হয় ? কেন ?
Ans. হাইড্রোজেনকে দুষ্ট মৌল বলে | কারণ 1 ও 17 উভয় শ্রেণীর মৌল গুলির সঙ্গে হাইড্রোজেন মৌলের ধর্মের মিল পাওয়া যায় | তাই এটিকে দুটো শ্রেণি এর মধ্যে যেকোনো একটিতে রাখা যায় |
- কোনটি সবচেয়ে হালকা নিষ্ক্রিয় গ্যাস ?
Ans. হিলিয়াম সবচেয়ে হালকা নিষ্ক্রিয় গ্যাস |
- কোনটি তীব্রতম তড়িৎ ঋণাত্মক মৌল?
Ans. বেরিলিয়াম তীব্র তড়িৎ ঋণাত্মক মৌল |
Multiple Choice Questions – 1 marks of পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ – PHYSICAL AND CHEMICAL PROPERTIES
আধুনিক পর্যায় সারণির কোন শ্রেণীতে নিষ্ক্রিয় মৌল গুলি থাকে –
a) 1 নং শ্রেণি
b) 2 নং শ্রেণি
c) 17 নং শ্রেণি
d) 18 নং শ্রেণি
Ans. d) 18 নং শ্রেণি |
একাধিক যােজ্যতা দেখা যায় –
a) সন্ধিগত মৌলের
b) ক্ষার ধাতুর
c)ক্ষারীয় মৃত্তিকা ধাতুর
d) হ্যালোজেনের
Ans. a) সন্ধিগত মৌলের
পর্যায় সারণিতে কি শ্রেণি বরাবর অপরিবর্তিত থাকে –
a) ঘনত্ব
b) পারমাণবিক ব্যাসার্ধ
c) যােজক ইলেকট্রন সংখ্যা
d) ধাতব ধর্ম।
Ans. c) যােজক ইলেকট্রন সংখ্যা
আধুনিক পর্যায় সারণীতে শ্রেণি সংখ্যা –
a) 12
b) 18
c) 10
d) 16
Ans. b) 18
মেন্ডেলিফের পর্যায় সারণি তৈরি হয় –
a) পারমাণবিক ব্যাসার্ধ
b) পারমাণবিক আয়তন
c) পারমাণবিক গুরুত্ব
d) পারমাণবিক সংখ্যা অনুসারে
Ans. c) পারমাণবিক গুরুত্ব
মুদ্রা ধাতু গুলি দীর্ঘ পর্যায় সারণিতে কোন গ্রুপে অবস্থিত –
a) 11
b) 15
c) 17
d) 1
Ans. a) 11
জারণ ক্ষমতা সবচেয়ে কম কোন মৌলের –
a) K
b) Na
c) Cs
d) Li
Ans. c) Cs
বিজারণ ক্ষমতা সর্বনিম্ন কোন মৌলের –
a) K
b) Na
c) Cs
d) Li
Ans. d) Li
এর মধ্যে কোনটি মুদ্রা ধাতু নয় –
a) Cu
b) Ag
c) Ag
d) Fe
Ans. d) Fe
আধুনিক দীর্ঘ পর্যায় সারণিতে কয়টি পর্যায় আছে –
a) 7
b) 10
c) 6
d) 14
Ans. a) 7
Short Questions – 2-3 marks of পদার্থের ভৌত ও রাসায়নিক ধর্মসমূহ – PHYSICAL AND CHEMICAL PROPERTIES
- কেন কঠিন অবস্থায় সােডিয়াম ক্লোরাইড তড়িৎ পরিবহণ করে না?
একটি কঠিন আয়নীয় যৌগ হলো সােডিয়াম ক্লোরাইড । এর মধ্যে বিপরীত আধানযুক্ত সােডিয়াম আয়ন এবং ক্লোরাইড আয়ন তীব্র আকর্ষণ বল যারা পরস্পর যুক্ত থাকে। এরা মুক্তভাবে চলাচল করতে পারে না। সে জন্য কঠিন অবস্থায় সােডিয়াম ক্লোরাইড তড়িৎ পরিবহণ করে না।
- কেন গলিত অবস্থায় সােডিয়াম ক্লোরাইড তড়িৎ পরিবহণ করে?
আয়নীয় যৌগ হওয়ায় সােডিয়াম ক্লোরাইড এর গলনাঙ্ক উচ্চ হয়। তাপ প্রয়ােগ করে গলিত অবস্থায় আনলে আয়নীয় বন্ধন অর্থাৎ সােডিয়াম আয়ন ও ক্লোরাইড আয়নের মধ্যে আকর্ষণ বল হ্রাস পায় এবং এরা মুক্তভাবে চলাচল করে বলে তড়িৎপ্রবাহ সম্পন্ন করে।
- মৃদু তড়িৎবিশ্লেষ্য ও তীব্র তড়িৎবিশ্লেষ্য -এর দুটি পার্থক্য উল্লেখ করাে।
মৃদু তড়িৎবিশ্লেষ্য জলীয় দ্রবণের তড়িৎ পরিবাহিতা খুবই কম এবং জলীয় দ্রবণে আংশিকভাবে আয়নে বিয়ােজিত হয়। অপরদিকে তীব্র তড়িৎবিশ্লেষ্য দ্রবণের তড়িৎ পরিবাহিতা উচ্চ এবং জলীয় দ্রবণের সম্পূর্ণভাবে আয়নিত হয়।
- তড়িৎবিশ্লেষণ কি?
যে প্রক্রিয়ায় গলিত বা উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থায় কোনাে তড়িৎবিশ্লেষ্য পদার্থের মধ্য দিয়ে তড়িৎপ্রবাহ চালনা করার ফলে পদার্থটির রাসায়নিক পরিবর্তন সম্পন্ন হয় তাকে তড়িৎবিশ্লেষণ বলে।
- অ্যানােড, ক্যাথােড ও ভােল্টামিটার সংজ্ঞা লেখো ?
অ্যানােড : যে তড়িৎদ্বারটি ব্যাটারির নেগেটিভ মেরুর সঙ্গে যুক্ত থাকে তাকে বলে অ্যানােড।
ক্যাথােড : যে তড়িৎদ্বারটি ব্যাটারির পজিটিভ মেরুর সঙ্গে যুক্ত থাকে তাকে ক্যাথােড বলে।
ভােল্টামিটার : যে পাত্রে তড়িৎবিশ্লেষ্য পদার্থ দ্রবীভূত অবস্থায় রেখে পদার্থটির তড়িৎবিশ্লেষণ করা হয় তাকে ভােল্টমিটার বলে।
- তড়িৎলেপন কাকে বলে ?
তড়িৎবিশ্লেষণ প্রক্রিয়ায় রাসায়নিকভাবে অধিক সক্রিয় কোনাে ধাতু বা ধাতু সংকরের ওপর অপেক্ষাকৃত কম সক্রিয় ধাতুর প্রলেপ দেওয়ার পদ্ধতিকে তড়িৎলেপন বলে।
তড়িৎলেপনের উদ্দেশ্য কী?
জলবায়ুর হাত থেকে কিংবা বিভিন্ন রাসায়নিক পদার্থের ক্রিয়া থেকে তামা, লােহা, পিতল প্রভৃতি ধাতু বা ধাতু সংকরের তৈরি বস্তুগুলিকে রক্ষা করার জন্য তড়িৎলেপন করা হয়। যেমন—মরিচার হাত থেকে লােহাকে রক্ষা করার জন্য লােহার উপর নিকেলের প্রলেপ দেওয়া হয়।
বিভিন্ন ধাতু বা ধাতু সংকরের সৌন্দর্য ও স্থায়িত্ব বাড়ানাের জন্য তড়িৎলেপন পদ্ধতি প্রয়ােগ করা হয়। যেমন—পিতলের ওপর সােনার প্রলেপ দিয়ে সৌন্দর্য বৃদ্ধি করা হয়।
- অ্যানােড মাড কি?
তামার বিশুদ্ধিকরণ-এর সময় অ্যানােডের নীচে তড়িৎবিশ্লেষণ পাত্রে যে পদার্থ অধঃক্ষিপ্ত হয়, তাকে অ্যানােড মাড বা অ্যানোেড কাদা বলে। এর মধ্যে মূল্যবান সােনা, রুপা এবং প্লাটিনাম ধাতু থাকে।

