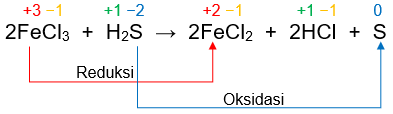আপনি এখানে শিখবেন এই অধ্যায়ে এবং বিষয়ের ফাউন্ডেশন অংশটা, এই বিষয়টিকে সহজ-সরলভাবে পড়িয়েছেন বিশেষজ্ঞ শিক্ষক ভিডিও লেকচার এর মাধ্যমে এবং এই পুরো অধ্যায়কে চার ভাগে খন্ডিত করে আপনার জন্য তৈরি করা হয়েছে
প্রথম খন্ডে আপনি শিখবেন ফাউন্ডেশন অংশটা যেখানে অধ্যায়ের ব্যাপারে আপনাকে বোঝানো হয়েছে তার মানে definitions,basics গুলো সহজভাবে. এবং এটাকে আপনি বুঝতে পারবেন যেটা আপনাকে পরীক্ষার জন্য ক্রীপের করতে সাহায্য করবে
দ্বিতীয় মডিউলে আপনি শিখবেন MCQ মাল্টিপল চয়েস কোশ্চেন যেটা সাধারণত এক Marks’er আসে পরীক্ষায়
তৃতীয় মডিউলে আপনি শিখবেন শর্ট অ্যানসার এবং কোয়েশ্চেন, যেটা আপনার পরীক্ষার সাজেশন মধ্যে পড়ে এবং এটা 3-4 marks’er প্রশ্ন আসে আপনার পরীক্ষা
চতুর্থ মডিউল আপনি শিখবেন লং আনসার এবং questions যেটা সাধারণত 5-6 marks er হয়
আপনার যদি কোন প্রশ্ন থাকে তাহলে আমাদের সাথে যোগাযোগ করুন যাতে কি আপনাকে আমরা সাহায্য করতে পারি
Here you will learn the basics of CHAPTER 3 – রাসায়নিক গণনা – Rosayonik Gonona in a simple language it is for Bengali medium students who are studying under West Bengal Board of Secondary Education and preparing for their exam (Class 10 WBBSE) Here you will find all necessary and important WBBSE Madhyamik Suggestions, notes, solved sample question paper in Bangla along with video lectures from expert teachers
রাসায়নিক গণনা
রাসায়নিক বিক্রিয়া : যে পদ্ধতির মাধ্যমে একটি পদার্থ বিশ্লিষ্ট হয়ে সম্পূর্ণ আলাদা ধর্ম যুক্ত একাধিক পদার্থ উৎপন্ন হয়ে থাকে অথবা একাধিক পদার্থ সংযুক্ত হয়ে সম্পূর্ণ পৃথক ধর্ম যুক্ত এক বা একাধিক পদার্থ উৎপন্ন হয় তাকেই আমরা রাসায়নিক বিক্রিয়া বলে থাকি।
রাসায়নিক সমীকরণ : চিহ্ন এবং সংকেতের সাহায্যে, কোন রাসায়নিক বিক্রিয়ায় অংশগ্রহণকারী বিকারক এবং বিক্রিয়াজাত পদার্থের অন্তর্গত পরমাণুগুলির মধ্যে সাম্যতা বজায় রেখে ওই রাসায়নিক বিক্রিয়াকে সংক্ষেপে প্রকাশ করার পদ্ধতিকে আমরা রাসায়নিক সমীকরণ বলে থাকি।
উদাহরণ :
ফেরিক ক্লোরাইডের হলুদ রঙের দ্রবণে হাইড্রোজেন সালফাইড গ্যাস চালনা করলে হাইড্রোক্লোরিক অ্যাসিড এবং বর্ণহীন ফেরাস ক্লোরাইড উৎপন্ন হয়ে থাকে; আর হলুদ রঙের সালফার অধঃক্ষিপ্ত হয়। এই বিক্রিয়াটিকে আমরা নিচে উল্লেখিত সমীকরণের সাহায্যে প্রকাশ করে থাকি।
রাসায়নিক বিক্রিয়ায় ভরের সংরক্ষণ :
ভরের নিত্যতা সূত্র : 1774 খ্রিস্টাব্দে বিজ্ঞানী ল্যাভয়সিয়ে দ্বারা প্রদত্ত ভরের নিত্যতা সূত্র থেকে আমরা জানতে পারি যে কোন রাসায়নিক বিক্রিয়ায় উৎপন্ন পদার্থ সমূহের মোট ভর বিক্রিয়ায় অংশগ্রহণকারী বিকারক পদার্থ সমূহের মোট ভরের সমান হয়ে থাকে। কোন বিক্রিয়ার আগে এবং পরে মোট ভরের কোন রূপ পরিবর্তন হয় না।
- মৌলের আপেক্ষিক পারমাণবিক ভর সর্বদা স্থির। রাসায়নিক বিক্রিয়ার আগে এবং পরে পরমাণুর ভর সংখ্যা সর্বদা সমান হয়।
- কোন রাসায়নিক বিক্রিয়ায় সাধারণত তাপ শোষণ বা উৎপন্ন হয়।
- আইনস্টাইনের বিখ্যাত আপেক্ষিক তত্ত্ব অনুযায়ী শক্তি এবং ভর সমতুল্য। m পরিমাণ ভর সম্পূর্ণরূপে E পরিমাণ শক্তিতে রূপান্তরিত হয় E=mc2 অনুযায়ী মেনে। সামান্য পরিমাণের পরিবর্তন প্রত্যেক রাসায়নিক বিক্রিয়ায় ঘটে থাকে। কিন্তু তা এতই নগণ্য যে তা পরিমাপ যোগ্য নয়।
ওজন ভিত্তিক রাসায়নিক গণনা :
রাসায়নিক সমীকরণের সাহায্যে আমরা, কি পরিমান বিক্রিয়ক ব্যবহার করলে কোন নির্দিষ্ট পরিমাণ বিক্রিয়াজাত পদার্থ আমরা পেতে পারি তা সবকিছুই নির্ণয় করতে পারি। কোন রাসায়নিক গণনা করার আগে আমাদের কিছু সুনির্দিষ্ট বিষয়ের উপর নজর দেওয়া দরকার।
- কোন একটি নির্দিষ্ট রাসায়নিক গণনার ক্ষেত্রে হয় এস আই অথবা সিজিএস পদ্ধতির একক ব্যবহার করা অনিবার্য।
- কোন রাসায়নিক বিক্রিয়ার সঠিক এবং সমতাযুক্ত সমীকরণ প্রথমে লিপিবদ্ধ করে নেওয়া উচিত।
- ভর নির্ধারণের ক্ষেত্রে, আমাদের মনে রাখতে হবে, কোন রাসায়নিক সমীকরণের উল্লেখিত ভর গুলি সর্বদা সমানুপাতে থাকে।
- কোন রাসায়নিক বিক্রিয়ায় অংশগ্রহণকারী বিকারক এবং উৎপন্ন পদার্থ সমূহের আপেক্ষিক পারমাণবিক ভর, মোল সংখ্যা, আপেক্ষিক আণবিক ভর ইত্যাদি যথাযথভাবে লিখে নেওয়া প্রয়োজন।
গ্যাসীয় পদার্থের বাষ্প ঘনত্ব (D)
= (কোন নির্দিষ্ট উষ্ণতা ও চাপে যেকোনো আয়তনের গ্যাসের ভর) /(ওই একই উষ্ণতা ও চাপে সমআয়তন হাইড্রোজেনের ভর)
অর্থাৎ কোন নির্দিষ্ট চাপ এবং উষ্ণতায় কোন নির্দিষ্ট আয়তনের গ্যাসীয় পদার্থ, সমআয়তন হাইড্রোজেন এর তুলনায় কত গুণ ভারী, তাকেই ওই গ্যাসের বাষ্প ঘনত্ব বলা হয়।
কোন গ্যাসের আপেক্ষিক আণবিক ভর (M) = 2 X ওই গ্যাসের বাষ্প ঘনত্ব (D) বা M=2D
কত গ্রাম CaCO₃ এর সাথে অতিরিক্ত লঘু HCl এর বিক্রিয়া ঘটালে, 66 গ্রাম CO₂ উৎপন্ন হবে?
(Ca = 20, C = 12, O = 16)
সংশ্লিষ্ট বিক্রিয়ার সমীকরণটি হলো:
CaCO₃ + 2HCL = CaCl₂ + CO₂ + 2H₂O
( 40 + 12 + 16 x 3 )=100 ( 12 + 16 x 2 ) = 44
সুতরাং আমরা বলতে পারি 44 গ্রাম কার্বন ডাই অক্সাইড তৈরি করতে 100 গ্রাম CaCO₃ এর প্রয়োজন হয়।
সুতরাং 64 গ্রাম কার্বন-ডাই-অক্সাইড তৈরি করতে (100 x 66) /44 অথবা 150 গ্রাম CaCO₃ এর প্রয়োজন হবে।
24.5 গ্রাম পটাশিয়াম ক্লোরেট কে উত্তপ্ত করলে কত গ্রাম অক্সিজেন পাওয়া যাবে?
(K = 39, Cl=35 .5, O = 16)
সংশ্লিষ্ট বিক্রিয়ার সমীকরণটি হল:
2KClO₃= 2KCl + 3O₂
2KClO₃= 2(39 + 35.5 + 3 x 16) = 245
3O₂= 3 (2 x 16) = 96
সুতরাং 245 গ্রাম পটাশিয়াম ক্লোরেট কে উত্তপ্ত করলে 96 গ্রাম অক্সিজেন উৎপন্ন হয়।
অর্থাৎ 24.5 গ্রাম পটাশিয়াম ক্লোরেট কে উত্তপ্ত করলে 9.6 গ্রাম অক্সিজেন উৎপন্ন হবে।
12.25 গ্রাম পটাশিয়াম ক্লোরেট বিয়োজিত হয়ে যে পরিমাণ অক্সিজেন উৎপন্ন করে তার সঙ্গে সম্পূর্ণরূপে বিক্রিয়া ঘটানোর জন্য প্রয়োজনীয় হাইড্রোজেনকে কত পরিমাণ জিংক এর সঙ্গে লঘু হাইড্রোক্লোরিক এসিডের বিক্রিয়ায় প্রস্তূত করা যাবে?
( Zn = 65, O = 16, H =1, K =39, Cl =35.5)
পটাশিয়াম ক্লোরেট থেকে অক্সিজেন তৈরি করার বিক্রিয়া সমীকরণটি হল 2KClO₃=2KCl+3O₂
2KClO₃= 2 (39 + 35.5 + 3×16) = 245
3O₂= (3 x 2 x 16) = 96
245 গ্রাম পটাশিয়াম ক্লোরেট থেকে 96 গ্রাম অক্সিজেন উৎপন্ন হয়।
12.25 গ্রাম পটাশিয়াম ক্লোরেট থেকে 96245 * 12.25= 4.8 গ্রাম অক্সিজেন পাওয়া যায়।
হাইড্রোজেন এবং অক্সিজেনের মধ্যে বিক্রিয়ার সমীকরণ টি হল:
2H₂+O2=2H₂O
2H₂= 2 x 2 x 1 = 4
O₂= 2 x 16= 32
32 গ্রাম অক্সিজেন 4 গ্রাম হাইড্রোজেন এর সঙ্গে বিক্রিয়া করে থাকে।
4.8 গ্রাম অক্সিজেন (4/32) x 4.8 = 0.6 গ্রাম হাইড্রোজেন এর সঙ্গে বিক্রিয়া করে।
জিংক এবং লঘু হাইড্রোক্লোরিক অ্যাসিডের রাসায়নিক বিক্রিয়া সমীকরণটি হলঃ
Zn+2HCl =ZnCl₂+H₂
Zn = 65
H₂= 2×1 = 2
2 গ্রাম হাইড্রোজেনকে প্রস্তুত করতে (65/ 2) x 0.6 বা 19.5 গ্রাম জিংক ব্যবহার করতে হবে।
10 গ্রাম ক্যালসিয়াম কার্বনেট কে খোলা জায়গায় উত্তপ্ত করলে, ওজনের কি পরিমাণ হ্রাস ঘটে? ( Ca = 40, C =12, O =16)
ক্যালসিয়াম কার্বনেট উত্তপ্ত হলে ক্যালসিয়াম অক্সাইড এর পরই অবশেষ পাওয়া যায় এবং কার্বন-ডাই-অক্সাইড গ্যাস উৎপন্ন হয়; অর্থাৎ ওজোন হ্রাসের পরিমাণ উৎপন্ন কার্বন ডাই অক্সাইডের ভরের সমান।
রাসায়নিক বিক্রিয়া টি হল :
CaCO₃=CaO+CO₂
CaCO₃= ( 40 + 12+ 3 x 16) = 100
CO₂2= (12+2x 16) = 44
অর্থাৎ 100 গ্রাম ক্যালসিয়াম কার্বনেট কে উত্তপ্ত করলে 44 গ্রাম কার্বন-ডাই-অক্সাইড তৈরি হয়।
10 গ্রাম ক্যালসিয়াম কার্বনেট কে উত্তপ্ত করলে 4.4 গ্রাম কার্বন ডাই অক্সাইড উৎপন্ন হয়।
সুতরাং ওজন হ্রাসের পরিমাণ = 4.4 গ্রাম।
বাণিজ্যিক জিংক এ 35% অশুদ্ধি বর্তমান। এরূপ 50 গ্রাম জিংক-এর সাথে অতিরিক্ত পরিমাণ পাতলা সালফিউরিক এসিডের বিক্রিয়ায় উৎপন্ন হাইড্রোজেন এর পরিমাণ কত হবে? ( Zn= 65, H =1)
অশুদ্ধির পরিমাণ 35%। সুতরাং আমরা বলতে পারি বিশুদ্ধ জিংক বর্তমান= 65%।
100 গ্রাম নমুনার মধ্যে জিংক এর পরিমান= 65 গ্রাম।
50 গ্রাম নমুনার মধ্যে জিংক এর পরিমান = 65/2 = 32.5
সংশ্লিষ্ট বিক্রিয়া রাসায়নিক সমীকরণ টি হল:
Zn +H2SO₄=ZnSO₄+H₂
Zn = 65
H₂= 2
65 গ্রাম জিংক থেকে ২ গ্রাম হাইড্রোজেন উৎপন্ন হয়
সুতরাং 32.5 গ্রাম জিংক থেকে 1 গ্রাম হাইড্রোজেন উৎপন্ন হবে।
7.0 গ্রাম ম্যাগনেসিয়াম কার্বনেট এর সঙ্গে 20 mL সালফিউরিক অ্যাসিডের বিক্রিয়া ঘটালে 0.7 গ্রাম লবণ অবশিষ্ট থাকে; সালফিউরিক অ্যাসিডের শতকরা মাত্রা নির্ধারণ করো। (H = 1, Mg= 24, O= 16, S= 32, C=12)
রাসায়নিক বিক্রিয়ায় ব্যবহৃত ম্যাগনেসিয়াম কার্বনেট এর পরিমাণ (7-0.7) = 6.3g।
রাসায়নিক সমীকরণ :
MgCO₃+H₂SO4 =MgSO₄+CO₂+H₂O
MgCO₃ = ( 24 + 12+ 3 x 16) = 84
H₂SO₄ = (1 x 2 + 32 +4 x 16) = 98
84 গ্রাম ম্যাগনেসিয়াম কার্বনেট এর সঙ্গে 98 গ্রাম সালফিউরিক অ্যাসিড বিক্রিয়া করে থাকে।
6.3 গ্রাম ম্যাগনেসিয়াম কার্বনেট এর সঙ্গে 7.35 গ্রাম সালফিউরিক অ্যাসিড বিক্রিয়া করে।
20 মিলি লিটার দ্রবণে, সালফিউরিক অ্যাসিডের পরিমাণ = 7.35 গ্রাম
100 মিলি লিটার দ্রবণে, সালফিউরিক অ্যাসিডের পরিমাণ = 7.35 x 5 = 36.75g
সুতরাং সালফিউরিক অ্যাসিডের মাত্রা 36.75 শতাংশ।
75 গ্রাম পটাশিয়াম ক্লোরেট এবং ম্যাঙ্গানিজ ডাই অক্সাইড এর মিশ্রণ কে উত্তপ্ত করলে উৎপন্ন অক্সিজেন ডাই অক্সাইডের পরিমাণ কত? (Cl=35.5, K=39, H=1, O=16)
ম্যাঙ্গানিজ ডাই অক্সাইড অনুঘটক রূপে কাজ করে এবং কোন রাসায়নিক বিক্রিয়া শেষে এর ভর অপরিবর্তিত থাকে।
অক্সিজেন এবং হাইড্রোজেন এর বিক্রিয়া সমীকরণ টি হল :
2H₂+O₂=2H₂O
2H₂ = 2 x 2 = 4
O₂ = 16 x 2 = 32
4 গ্রাম হাইড্রোজেন 32 গ্রাম অক্সিজেনের সাথে বিক্রিয়া করে থাকে।
সুতরাং তিন গ্রাম হাইড্রোজেন 24 গ্রাম অক্সিজেনের সাথে বিক্রিয়া ঘটায়।
পটাশিয়াম থেকে অক্সিজেন উৎপাদনের সমীকরণ :
2KClO₃ + [MnO₂] = 2KCl + 3O₂ + [MnO₂]
2KClO₃= 2 (39+35.5+16 x 3) = 245
3O₂= 3 x 32 =96
96 গ্রাম অক্সিজেন তৈরি করতে KClO₃ লাগে 245 গ্রাম
24 গ্রাম অক্সিজেন তৈরি করতে KClO₃লাগবে = (245 x 24)/ 96 = 61.25
পটাশিয়াম ক্লোরাইড এর পরিমান= 61.25 g
ম্যাঙ্গানিজ ডাই অক্সাইডের পরিমাণ= (75- 61.25) = 13.75 গ্রাম
লোহার সাথে লঘু সালফিউরিক অ্যাসিডের বিক্রিয়ায় হাইড্রোজেন উৎপন্ন হয়; আবার লোহার সাথে স্টিমের বিক্রিয়া ঘটালে সেক্ষেত্রেও হাইড্রোজেন উৎপন্ন হয়। 4 গ্রাম হাইড্রোজেন তৈরি করতে গেলে কোন ক্ষেত্রে লোহার পরিমাণ কম হবে? (Fe= 56, O=16, H=1)
লোহার সাথে লঘু সালফিউরিক অ্যাসিডের বিক্রিয়ার রাসায়নিক সমীকরণ :
Fe + H₂SO₄ = FeSO₄ + H₂
Fe = 56
H₂ = 2
অর্থাৎ 2 গ্রাম হাইড্রোজেন তৈরি করতে 56 গ্রাম লোহার প্রয়োজন হয়।
চার গ্রাম হাইড্রোজেন তৈরি করতে 112 গ্রাম লোহার লাগবে।
আবার লোহার সাথে স্টিমের রাসায়নিক বিক্রিয়ার সমীকরণ :
3Fe + 4H₂O = Fe₃O₄ + 4H₂
3Fe = 3 x 56 = 168
4H₂ = 4 x 2 = 8
8 গ্রাম হাইড্রোজেন তৈরি করতে লোহা লাগে 168 গ্রাম;
4 গ্রাম হাইড্রোজেন তৈরি করতে লোহা লাগে 84 গ্রাম।
সুতরাং আমরা দেখতে পাচ্ছি দ্বিতীয় ক্ষেত্রের লোহা কম লাগে। তাই লোহা এবং স্টিমের বিক্রিয়ায় কম পরিমাণে লোহা লাগবে।
20 গ্রাম কঠিন যৌগ A কে উত্তপ্ত করলে অপর একটি কঠিন যৌগ B এর 9 গ্রাম এবং একটি বর্ণহীন ও গন্ধহীন গ্যাস C উৎপন্ন হয়। উৎপন্ন গ্যাসটির STP তে আয়তন 5.6 লিটার। গ্যাসটির আপেক্ষিক আণবিক ভর নির্ণয় করো।
A(s) 🠒 B(s) + C(g)
A এর ভর = 20 গ্রাম
B এর ভর = 9 গ্রাম
ভরের সংরক্ষণ অনুযায়ী, C গ্যাসের ভর হবে= (20-9) = 11 গ্রাম
STP তে 5.6 লিটার C গ্যাসের ভর = 11 গ্রাম
STP তে 1 লিটার C গ্যাসের ভর = 11 / 5.6 গ্রাম
STP তে 22.4 লিটার C গ্যাসের ভর = ( 11 X 22.4) / 5.6 গ্রাম = 44 গ্রাম
সুতরাং C গ্যাসের আপেক্ষিক আণবিক ভর = 44
32.5 গ্রাম দস্তার সঙ্গে অতিরিক্ত লঘু সালফিউরিক অ্যাসিড এর বিক্রিয়া ঘাটালে যে হাইড্রোজেন গ্যাস সৃষ্টি হয় তার STP তে আয়তন কত? (Zn = 65)
রাসায়নিক বিক্রিয়ার সমীকরণটি :
Zn + H₂SO₄ 🠒ZnSO₄ + H₂
Zn = 65
H₂ = STP তে 22.4 লিটার
STP তে 65 গ্রাম দস্তা, 22.4 লিটার হাইড্রোজেন উৎপন্ন করে থাকে।
সুতরাং 32.5 গ্রাম দস্তা 11.2 লিটার হাইড্রোজেন উৎপন্ন করবে।
SOLVED QUESTIONS & ANSWERS of রাসায়নিক গণনা – Rosayonik Gonona
1 MARKS QUESTIONS of রাসায়নিক গণনা – Rosayonik Gonona
1. C-12 স্কেলে কোনাে মৌলের পারমাণবিক ভরের সংজ্ঞা দাও।
অনুরুপ প্রশ্ন : C-12 স্কেলে ‘আণবিক ভরের সংজ্ঞা দাও।
উত্তর : কোনাে মৌলের একটি পরমাণু একটি C12 পরমাণুর ভরের 1/12 অংশে তুলনায় যত গুণ ভারী সেই সংখ্যাই হলাে C:12 স্কেলে ওই মৌলের পারমাণবিক ভর।
পারমাণবিক ভর = মৌলের একটি পরমাণুর ভর 112 X 1টি কার্বন পরমাণুর ভর
Multiple Choice Questions – of রাসায়নিক গণনা – Rosayonik Gonona 1 marks
ভরের সংরক্ষণ সূত্রের প্রবর্তক কে?
- ডালটন
- আরহেনিয়াস
- ল্যাভয়সিয়ে
- প্রউস্ট
Ans – 3
A ও B বিক্রিয়া করে C এবং D উৎপন্ন করলে, এদের মধ্যে কোনটি সত্য হবে?
- A ও B-এর মােট ভর >C ও D-এর মােট ভর।
- A ও B-এর মােট স্তর < ৫ ও D-এর মােট ভর।
- A ও B-এর মােট ভর = C ও D-এর মােট ভর
- A-এর ভর = B-এর ভর এবং C-এর ভর = D-এর ভর
ans-3
এদের মধ্যে কোনটি ভর ও শক্তির তুল্যতা সমীকরণ?
- E2=mc
- E = mc^2
- E = mc
- E = mc
Ans- 2
রাসায়নিক সমীকরণ থেকে কোন বিষয়টি জানা যায় না?
- বিক্রিয়ক ও বিক্রিয়াজাত পদার্থের মােল-সংখ্য
- STP-তে বিক্রিয়ক ও বিক্রিয়াজাত পদার্থের আয়তন
- বিক্রিয়ক ও বিক্রিয়াজাত পদার্থের গাঢ়ত্ব
- বিক্রিয়ক ও বিক্রিয়াজাত পদার্থের ভর
Ans- 3
E = mc² সমীকরণটির সাথে কোন বিজ্ঞানীর সৃষ্টি?
- নিউটন।
- অ্যাভোগাড্রো
- পল্যঙ্ক
- আইনস্টাইন
Ans- 4
ভরের পরিমাপযােগ্য পরিবর্তন কোন প্রকার বিক্রিয়ার দ্বারা ঘটে ?
- সাধারণ রাসায়নিক বিক্রিয়া
- নিউক্লিয় বিক্রিয়া
- তাপমােচী বিক্রিয়া
- তাপগ্রাহী বিক্রিয়া
Ans- 2
E = mc² সমীকরণে E, m ও c যথাক্রমে
- শূন্য মাধ্যমে আলাের বেগ, ভর ও শক্তি
- শক্তি, ভর ও শূন্য মাধ্যমে আলাের বেগ
- শক্তি, শূন্য মাধ্যমে আলোর বেগ ও ভর
- ভর, শক্তি ও শূন্য মাধ্যমে আলাের বেগ
Ans:- 2
ভর ও শক্তির মোট পরিমাণ যে-কোনাে পরিবর্তনের পরে
- হ্রাস পায় ও বৃদ্ধি পায়
- হ্রাস পায়
- বৃদ্ধি পায়
- একই থাকে
Ans- 4
কোনাে পদার্থের ভর ও মােল-সংখ্যার মধ্যে কি সম্পর্ক ?
- মোল সংখ্যা = প্রদত্ত ভর/মােলার ভর
- মোলের ভর = মােল-সংখ্যা/ প্রদত্ত ভর
- মােল সংখ্যা = মােলার ভর
- মােল-সংখ্যা = প্রদত্ত ভর X মােলার ভর
Ans- 1
- 64g NH₂NO₂ এর বিয়ােজনের দ্বারা কত পরিমান N₂ উৎপন্ন হয় ?
- 28g
- 32g
- 40g
- 14g
Ans- 1
Short Questions – of রাসায়নিক গণনা – Rosayonik Gonona 2-3 marks
- 10 গ্রাম ক্যালশিয়াম কার্বনেটের সঙ্গে অতিরিক্ত লঘু হাইড্রোক্লোরিক অ্যাসিডের বিক্রিয়ায় কার্বন ডাই-অক্সাইড উৎপন্ন হলাে।
(1) কত গ্রাম কার্বন ডাই-অক্সাইড উৎপন্ন হলাে ?
(2) এক্ষেত্রে কত মােল কার্বন ডাই-অক্সাইড উৎপন্ন হলাে?
(3) STP-তে ওই কার্বন ডাই-অক্সাইডের আয়তন কত হবে?
উত্তর : বিক্রিয়ার শমিত সমীকরণটি হলাে—
CaCO3 + 2HCl = CaCl2 + CO2 + 2H2O
(40+12+16×3) (12+16×2)
= 100 gm = 44 gm
অর্থাৎ
100 গ্রাম ক্যালশিয়াম কার্বনেট থেকে কার্বন ডাই-অক্সাইড পাওয়া যায় 44 গ্রাম
10 গ্রাম ক্যালশিয়াম কার্বনেট থেকে কার্বন ডাই-অক্সাইড পাওয়া যায় = 4.4 গ্রাম
2) এখন 44 গ্রাম CO2 =1 মোল CO2
4.4 গ্রাম CO2 = 0.1 মােল CO2
3) STP-তে। মােল C02-এর আয়তন = 22.4 লিটার
0.1 মােল CO2-এর ‘আয়তন = 2.24 লিটার।
- কোনাে গ্যাসের বাষ্পঘনত্ব 16 হলে ওই গ্যাসের আণবিক গুরুত্ব কত?
উত্তর : অ্যাভােগাড্রো সূত্রের অনুসিদ্ধান্ত থেকে আমরা জানি,
গ্যাসের আণবিক গুরুত্ব = 2 x বাষ্পঘনত্ব = 2 × 16 = 32।
সুতরাং, গ্যাসটির আণবিক গুরুত্ব = 32।